Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
a, Giả sử: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{22,4}{22,4}=1\left(mol\right)\left(1\right)\)
Ta có: \(n_{CO_2}=\dfrac{35,84}{22,4}=1,6\left(mol\right)\)
Theo PT: \(\Sigma n_{CO_2}=n_{CH_4}+2n_{C_2H_2}\)
\(\Rightarrow x+2y=1,6\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,4}{1}.100\%=40\%\\\text{ }\%V_{C_2H_2}=60\%\end{matrix}\right.\)
b, Theo PT: \(\Sigma n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=2,3\left(mol\right)\)
\(\Rightarrow m_{O_2}=2,3.32=73,6\left(g\right)\)
c, PT: \(CO_2+2NaOH\rightarrow Na_2CO_3+H_2O\)
Theo PT: \(n_{Na_2CO_3}=n_{CO_2}=1,6\left(mol\right)\)
\(\Rightarrow C_{M_{Na_2CO_3}}=\dfrac{1,6}{0,8}=2M\)
Bạn tham khảo nhé!

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\left(1\right)\)
\(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,25\left(mol\right)\\n_{C_2H_2}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,25.22,4}{6,72}.100\%\approx83,33\%\\\%V_{C_2H_2}\approx16,67\%\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=0,625\left(mol\right)\Rightarrow m_{O_2}=0,625.32=20\left(g\right)\)

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
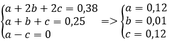
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

\(n_{hhkhí}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\\ n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ Gọi\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_2}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O
a 2a a
2C2H2 + 5O2 \(\underrightarrow{t^o}\) 4CO2 + 2H2O
b 2,5b 2b
Hệ phương trình: \(\left\{{}\begin{matrix}a+b=0,125\\2a+2,5b=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,025\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\)
\(\%V_{C_2H_2}=\dfrac{0,1}{0,125}=80\%\\ \%_{CH_4}=100\%-80\%=20\%\)
nCO2 = 2.0,025 + 2.0,1 = 0,25 (mol)
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
0,25 0,25
=> mCaCO3 = 0,25.100 = 25 (g)

a)
\(m_{C_2H_2} = m_{tăng} = 5,2\ gam\\ \Rightarrow n_{C_2H_2} = \dfrac{5,2}{26} = 0,2(mol)\)
Vậy :
\(\%V_{C_2H_2} = \dfrac{0,2.22,4}{8,96}.100\% = 50\%\\ \%V_{CH_4} = 100\%-50\% = 50\%\)
b)
\(n_{CH_4} = n_{C_2H_2} = 0,2(mol)\)
CH4 + O2 \(\xrightarrow{t^o}\) CO2 + H2O
0,2.........................0,2...................................(mol)
C2H2 + \(\dfrac{5}{2}\)O2 \(\xrightarrow{t^o}\) 2CO2 + H2O
0,2................................0,4.................................(mol)
CO2 + Ca(OH)2 → CaCO3 + H2O
(0,2+0,4)............................(0,2+0,4)........................................(mol)
\(\Rightarrow m_{CaCO_3} =(0,2 + 0,4).100 = 60(gam)\)

CH4+2O2-to>CO2+2H2O
x-----------------------------2x
C2H2+\(\dfrac{5}{2}\)O2-to>2CO2+H2O
y-----------------------------------y
=>\(\left\{{}\begin{matrix}x+y=\dfrac{3,36}{22,4}\\2x+y=\dfrac{4,5}{18}\end{matrix}\right.\)
=>\(\left\{{}\begin{matrix}x=0,1\\y=0,05\end{matrix}\right.\)
=>%VCH4=\(\dfrac{0,1.22,4}{3,36}\).100=66,67%
=>%VC2H2=100-66,67%=33,33%
b)
C2H2+2Br2->C2H2Br4
0,05-----0,1 mol
=>m Br2=0,1.160=16g

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%