Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{H_2}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\) \(\Rightarrow m_{H_2}=0,045\cdot2=0,09\left(g\right)\)
Bảo toàn nguyên tố: \(n_{HCl}=2n_{H_2}=0,09\left(mol\right)\) \(\Rightarrow m_{HCl}=0,09\cdot36,5=3,285\left(g\right)\)
Bảo toàn khối lượng: \(m_{KL}=m_{muối}+m_{H_2}-m_{HCl}=1,38\left(g\right)\)

hòa tan hoàn toàn khối lượng Fe và Cu(tỉ lệ 1:1) bằng axit HNO3 thu được V lít hỗn hợp khí X gồm NO và NO2 và dung dịch Y (chỉ chứa 2 muốivà axit ) tỉ khối của X đối với H2 bằng 19. tính V
các bạn giải theo cách bảo toàn electron nha
a) Ta có: nH2 = 1,008/22.4 = 0,045 \(\rightarrow\) nHCl = 0,045 x 2= 0,09mol
mA = mmuối - mCl = 4,575 - 0,09 x 35,5 = 1,38g
Đặt x, y lần lượt là số mol của Fe, M và n là hóa trị của M trong hợp chất. Từ 2 phương trình ta có:
56x + My = 1,38 (1)
2x + ny = 0,09 (2)
b) Ở câu b này mình cho rằng đó là H2SO4 đặc chứ ko phải loãng vì nếu loãng thì ta ko thu được hh khí có tỉ khối hơi như vậy.
Các phương trình phản ứng:
Fe + 6HNO3 \(\rightarrow\) Fe(NO3)3 +3NO2 + 3H2O
M + 2nHNO3\(\rightarrow\) M(NO3)n + nNO2 + nH20
2Fe + 6H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3SO2 + 6H2O
2M + 2nH2SO4 \(\rightarrow\) M2(SO4)n + nSO2 + 2nH2O
Ta có: dkhí/ H2 =25,25 \(\rightarrow\) Mkhí = 50,5
Số mol 2 khí=1,8816:22,4=0,084mol
lập hệ giải ra: nNO2 = 0,063, nSO2 = 0,021
Ta có các phương trình e như sau:
Fe \(\rightarrow\) Fe3+ + 3e
x---------------3x
M \(\rightarrow\) Mn+ + ne
y--------------ny
N5+ + 1e \(\rightarrow\) N4+
0,063 \(\leftarrow\) 0,063
S6+ + 2e\(\rightarrow\) S4+
0,042 \(\leftarrow\) 0,021
Tổng e nhận = tổng e nhường nên :
3x + ny = 0,063 + 0,042 = 0,105
kết hợp với (2) suy ra được x = 0,015
ny = 0,06 \(\rightarrow\) y = 0,06/n
Thay vào (1) \(\rightarrow\) M = 9n
Biện luận thì tìm được M là Al.

Câu 1
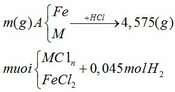
Áp dụng định luật bảo toàn nguyên
tố H ta có:
nHCl = 2nH2 = 2.0,045 = 0,09 mol
Áp dụng định luật bảo toàn khối lượng
ta có: mA + mHCl = m muối + mH2
=> m = m muối + mH2 – mA = 4,575 + 0,045.2 – 0,09.36,5 = 1,38 (gam)
Câu 2
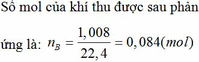
Do cho kim loại phản ứng với H2SO4 đặc và HNO3 đặc nên khí sinh ra là SO2 và NO2.
Áp dụng phương pháp đường chéo ta có:
SO2: 64 4,5
50,5
NO2: 46 13,5
→nSO2=nNO2=4,513,5=13
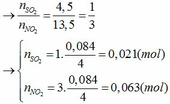
Đặt số mol của Fe và M lần lượt là x và y (mol)
- Khi cho hỗn hợp tác dụng với HCl:
Fe + 2HCl → FeCl2 + H2
x x (mol)
M + nHCl → MCln + 0,5nH2
y 0,5ny (mol)
nH2 = 0,045 => x + 0,5ny = 0,045 (1)
- Khi cho hỗn hợp tác dụng với HNO3 đặc và H2SO4 đặc:
Ta có các bán phản ứng oxi hóa – khử:
Fe → Fe3+ + 3e
x 3x
M → Mn+ + ne
y ny
S+6 + 2e → S+4 (SO2)
0,021 0,042
N+5 + 1e → N+4 (NO2)
0,063 0,063
Áp dụng định luật bảo toàn electron ta có: 3x + ny = 0,042 + 0,063 hay 3x + ny = 0,105 (2)
Từ (1) và (2) ta có hệ phương trình sau:
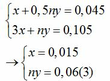
Mặt khác: mA = mFe + mM => 1,38 = 0,015.56 + My => My = 0,54(4)
Từ (3) và (4) suy ra M = 9n
Ta có bảng sau:
| n |
1 |
2 |
3 |
| M |
9 (loại) |
18 (loại) |
27 (nhận) |
Vậy kim loại M là nhôm, kí hiệu là Al.

PT: \(A_2CO_3+2HCl\rightarrow2ACl+H_2O+CO_2\)
\(BCO_3+2HCl\rightarrow BCl_2+H_2O+CO_2\)
Có: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2O}=n_{CO_2}=0,15\left(mol\right)\\n_{HCl}=2n_{CO_2}=0,3\left(mol\right)\end{matrix}\right.\)
Theo ĐLBT KL, có: mx + mHCl = mmuối + mH2O + mCO2
⇒ mmuối = 18 + 0,3.36,5 - 0,15.18 - 0,15.44 = 19,65 (g)
Bạn tham khảo nhé!
\(n_{CO_2}=0,15\left(mol\right)\)
=> \(n_{HCl}=2n_{CO_2}=0,3\left(mol\right)\)
Ta có : \(m_{muốiclorua}=m_{muốicacbonat}-m_{CO_3^{2-}}+m_{Cl^-}\)
=> \(m_{muốiclorua}=18+0,15.60-0,3.35,5=19,65\left(g\right)\)

Vì tỉ lệ số mol của M và Fe trong A là 2:3.
=> Gọi số mol là 2a mol M và 3a mol Fe
Gọi hóa trị của kim loại M là n
Phần 1:
3Fe + 2O2 → Fe3O4
3a------------------->a
4M + 3O2 → 2M2O3
2a------------------->a
Phần 2:
Fe + 2HCl → FeCl2 + H2
3a ------------------------------->3a
M + nHCl → MCln + \(\dfrac{n}{2}\)H2
2a -----------------------> a.n
=> 3a + a.n = \(\dfrac{26,88}{22,4}\) = 1,2 (*)
Phần 3:
2Fe + 3Cl2 → 2FeCl3
3a ----> \(\dfrac{9}{2}\)a
2M + nCl2 → 2MCln
2a -----> n.a
=> \(\dfrac{9}{2}\)a + n.a = \(\dfrac{33,6}{22,4}\) = 1,5 (**)
Từ (*) và (**) => a = 0,2 và n = 3
Ta có : 0,2.232 + 0,2(2M + 16.3) = 66,8
=> M = 27 (g/mol)
=> Kim loại M là nhôm (Al)
=> m Al ban đầu = 0,4.27.3= 32,4 (g)
mFe ban đầu = 0,6.56.3 = 100,8 (g)

a) \(n_{H_2}=0,2\left(mol\right)\)
Bảo toàn nguyên tố H : \(n_{HCl}=2n_{H_2}=0,4\left(mol\right)\)
=> \(n_{Cl^-}=0,4\left(mol\right)\)
=> \(m_{muối}=m_{KL}+m_{Cl^-}=20+0,4.35,5=34,2\left(g\right)\)

\(n_{HCl}=0.2\cdot2=0.4\left(mol\right)\)
\(BTKL:\)
\(m_{hh}+m_{HCl}=m_M+m_{H_2}\)
\(\Rightarrow m_M=8+0.4\cdot36.5-0.2\cdot2=22.2\left(g\right)\)
\(n_{Fe}=n_M=a\left(mol\right)\)
\(\Rightarrow a\left(56+M\right)=8\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(\Rightarrow a+\dfrac{an}{2}=0.2\)
\(\Rightarrow a\left(1+\dfrac{n}{2}\right)=0.2\left(2\right)\)
\(\dfrac{\left(1\right)}{\left(2\right)}=\dfrac{a\left(56+M\right)}{a\left(1+\dfrac{n}{2}\right)}=\dfrac{8}{0.2}=40\)
\(\Rightarrow56+M=40\left(1+\dfrac{n}{2}\right)\)
\(\Rightarrow56+M=40+20n\)
\(\Rightarrow M-20n+16=0\)
\(BL:\)
\(n=2\Rightarrow M=24\)
\(M:Mg\)
\(\)
\(n_{H_2}=0,045mol\\ \text{Bảo toàn nguyên tố H:}\\ 2.n_{H_2}=n_{HCl}=0,09mol\\ \text{BTKL}\\ m_{hh}+m_{HCl}=m_{Khan}+m_{H_2}\\ m_{hh}+0,09.36,5=4,575+0,045.2\\ m_{hh}=1,38g\)