K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

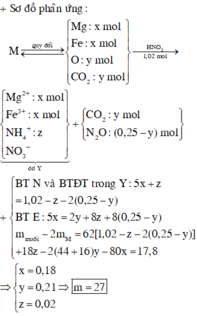
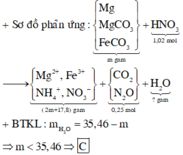
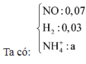
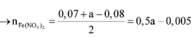
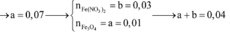




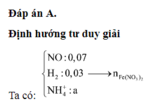
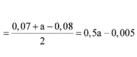
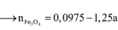
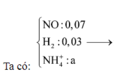
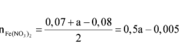

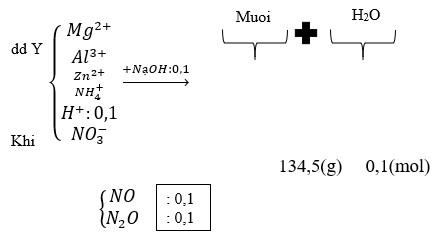

Hỗn hợp Z chắc chắn có NO. MZ = 24,4 ⇒ Có H2.
⇒ Sơ đồ đường chéo ⇒ nNO : nH2 = 4 : 1
+ Đặt nNH4 = c ta có sơ đồ:
+ Phương trình bảo toàn điện tích: 4nZn = 8nNH4+ + 3nNO + 2nH2
8a = 8c + 4b×3 + b×2 8a – 14b – 8c = 0 (1).
+ Phương trình bảo toàn điện tích: 2nZn2+ + nNa+ + nNH4+ = nCl–
14a + 0,19 + c = 1,62 14a + c = 1,43 (2).
+ Phương trình bảo toàn nitơ: nNH4+ + nNOub> = nNaNO3
c×1 + 4b×1 = 0,19 4b + c = 0,19 (3)
+ Giải hệ (1) (2) và (3) ⇒ a = 0,1 và c = 0,03
⇒ mMuối = 7×0,1×65 + 0,19×23 + 0,03×18 + 1,62×35,5 = 107,92 gam
Đáp án D