Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: \(n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Coi hh chất rắn gồm M và O.
⇒ nO = 0,15.2 = 0,3 (mol)
Ta có: \(n_M=\dfrac{16,2}{M_M}\left(mol\right)\)
BT e, có: n.nM = 2nO + 2nSO2 + 6nS
\(\Rightarrow\dfrac{16,2n}{M_M}=1,8\Rightarrow M_M=9n\left(g/mol\right)\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
Vậy: M là Al.

Ta có: \(n_M=\dfrac{7}{M_M}\left(mol\right)\)
\(n_{SO_2}=0,1875\left(mol\right)\)
Giả sử: M có hóa trị cao nhất là a.
⇒ Số e cho là a.
Theo ĐLBT mol e, có: \(\dfrac{7a}{M_M}=0,1875.2\)
\(\Rightarrow M_M=\dfrac{56a}{3}\left(g/mol\right)\)
Với a = 1 ⇒ MM = 56/3 (loại)
a = 2 ⇒ MM = 112/3 (loại)
a = 3 ⇒ MM = 56 (nhận)
Vậy: M là Fe.
Bạn tham khảo nhé!

Gọi kim loại cần tìm là R hóa trị n
Gọi : nFe = a mol ; nR = b mol
⇒ 56a + Rb = 8,3(1)
Trường hợp 1 : Kim loại R tan trong HCl
\(Fe +2 HCl \to FeCl_2 +H_2\\ 2R + 2nHCl \to 2RCl_n + nH_2\\ n_{H_2} = a + 0,5bn = \dfrac{5,6}{22,4} = 0,25(2)\)
Bảo toàn e :
\(2n_{SO_2} = 3n_{Fe} + n.n_R\\ \Rightarrow 3a + bn = \dfrac{6,72}{22,4}.2 = 0,6(3)\)
Từ (2)(3) suy ra: a = 0,1 ; bn = 0,3 ⇒ b = \(\dfrac{0,3}{n}\)
Ta có :0,1.56 + \(\dfrac{0,3}{n}.R = 8,3\)
Suy ra: R = 9n
Với n = 3 thì R = 27(Al)
Trường hợp 2 : Kim loại R không phản ứng với HCl
\(n_{Fe} = n_{H_2} = 0,25(mol)\\ \)
BT electron :
\(n_R = \dfrac{0,3.2 - 0,25.3}{n} = \dfrac{-0,15}{n}<0\)(Loại)

Ta có: \(n_{SO4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ M_M=\dfrac{18}{0,2}=65\)
Vậy kim loại cần tìm là Zn

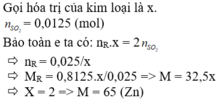

M + 2H2SO4 => MSO4 + SO2 + 2H20
nSO2 = 1.68/22.4 = 0.075 MOL
=> nKIM LOẠI M = 0.075 mol
M của Kl M = m/n = 4.8/0.075 = 64 => Cu
nSO2 = 1.68 / 22.4 = 0.075 (mol)
M + 2H2SO4(đ) => MSO4 + SO2 + 2H2O
0.075....................................0.075
MM = 4.8 / 0.075 = 64
=> M là : Cu