Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Xem hỗn hợp ban đầu được tạo thành từ: Fe, Cu và O2
Fe -------> Fe3+ + 3e
x.........................3x
Cu -------> Cu2+ + 2e
y..........................2y
O2 + 4e -----> 2O2-
z.........4z
S+6 + 2e -------> S+4
...........0,045..........0,0225
Gọi x, y, z là số mol Fe, Cu, O2. Ta có hệ gồm 3 pt:
56x + 64y + 32z = 2,44
3x + 2y = 4z + 0,045
0,5*400x + 160y = 6,6
=> x = 0,025, y = 0,01, z = 0,0125
=> %mCu = 0,01*64/2,44*100% = 26,23%

Vì ta có thể tính được ngay số mol của N2 và H2 và đây cũng là dự kiện mấu chốt để tìm m với dạng toàn này nên đầu tiên ta tìm số mol của N2 và H2 bằng cách: đặt nN2 và H2 lần lượt là x, y. Ta được: x + y = 0,025
tỉ khối so với H2: 28x + 2y/ 2(x + y) = 11,4 (với x + y = 0,025)
=> x = 0,02; y = 0,005
Sử dụng bảo toàn electron: số mol electron nhường = số mol electron nhận thì: 2nMg > ***N2 + 2nH2 nên phản ứng có tạo NH4Cl
quá trình oxi hóa: Mg - 2e -----> Mg2+
quá trình khử: 2NO3- -10e ----> N2 (N(+5) -5e ----> N(0))
NO3- -8e ------> NH4+ (n(+5) - 8e ---> N(-3))
2H+ -2e ---> H2
Vậy 2.0,124 = 0,025.10 + 0,005.2 + 8nNH4+ => nNH4+ = 0,01
m = mMgCl2 + mNH4Cl = 0,145.95 + 0,01.53,5 = 14,31 gam
mol Mg = 0,145 ==> mol e nhường = 0,29 ==> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005
mol HCl = mol Cl- = mol H+ = 0,35
mol KNO3 = mol K+ = mol NO3- = 0,05
muối gồm : Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24*0,145 + 39*0,05 + 35,5*0,35 = 18,035

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.
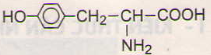 với các chất sau:
với các chất sau:
Đáp án A
BTKL: mX + mHCl = mKhí + mY + mH2O
=> mH2O = 18,025 + 0,48.36,5 – 27,2.0,05 – 30,585= 3,6 (g) => nH2O = 0,2 (mol)
nH+dư ( trong Y) = 4nNO = 4. 0,005 = 0,02 (mol)
BTNT Cl => nAgCl = 0,48 (mol) => nAg = ( 72,66 – 0,48.143,5)/108 = 0,035 (mol)
Gọi a, b, c lần lượt là số mol của Zn, Fe(NO3)2 và Fe2O3 trong X
=> mX = 65a + 180b + 160c = 18,025 (1)
BTNT O: 6nFe(NO3)2 + 3nFe2O3 = nN2O + nNO + 2nH2O
=> nN2O + nNO = 6b + 3c -0,2
=> nH2 = ∑ nKhí - nN2O + nNO = 0,25 – 6b – 3c