Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
Coi V dd HCl = 100(ml)
m dd HCl = 1,25.100 = 125(gam)
n HCl = 125.7,3%/36,5 = 0,25(mol)
[H+ ] = [Cl- ] = CM HCl = 0,25/0,1 = 2,5M
b)
n Al = 0,235(mol)
2Al + 6HCl $\to$ 2AlCl3 + 3H2
n HCl pư = 3n Al = 0,705(mol)
n HCl dư = 0,4.2 - 0,705 = 0,095(mol)
[H+ ] = CM HCl dư = 0,095/0,4 = 0,2375M
pH = -log([H+ ]) = 0,624

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\)
\(BTe:\) \(2n_{Fe}+2n_{Zn}=2n_{H_2}\)
\(BTKL:\) \(56n_{Fe}+65n_{Zn}=18,6\)
\(\Rightarrow\left\{{}\begin{matrix}Fe:0,1mol\\Zn:0,2mol\end{matrix}\right.\)\(\Rightarrow\left\{{}\begin{matrix}m_{Fe}=0,1\cdot56=5,6g\\m_{Zn}=65\cdot0,2=13g\end{matrix}\right.\)

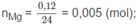
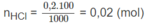
Mg + 2HCl → M g C l 2 + H 2
1 2 (mol)
0,005 0,01 mol
Số mol HCl còn lại sau phản ứng: 0,02 - 0,01 = 0,01 (mol).
Từ đó, số mol HCl trong 1000 ml là 0,1 mol, nghĩa là sau phản ứng
[HCl] = 0,1M = 1. 10 - 11 . 10 - 1 M.
Vậy pH = 1.

\(n_{H^+}=0,5.0,2=0,1\left(mol\right)\)
\(n_{OH^-}=0,5.0,3=0,15\left(mol\right)\)
\(\Rightarrow n_{OH^-dư}=0,15-0,1=0,05\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]_{\text{sau pư}}=\dfrac{0,05}{0,5}=0,1\)
\(\Rightarrow\left[H^+\right]=10^{-13}\)
\(\Rightarrow pH=13\)

Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,5\cdot1,232=0,616\left(mol\right)\\n_{H^+}=0,2\cdot0,2=0,04\left(mol\right)\\n_{Al^{3+}}=0,2\cdot0,8=0,16\left(mol\right)\end{matrix}\right.\)
PT ion: \(H^++OH^-\rightarrow H_2O\)
0,04____0,04 (mol)
\(Al^{3+}+3OH^-\rightarrow Al\left(OH\right)_3\downarrow\)
0,16_____0,48________0,16 (mol)
\(Al\left(OH\right)_3+OH^-\rightarrow AlO_2+2H_2O\)
0,096____0,096 (mol)
\(\Rightarrow n_{Al\left(OH\right)_3\left(dư\right)}=0,16-0,096=0,064\left(mol\right)\)
Bảo toàn nguyên tố: \(n_{Al_2O_3}=\dfrac{1}{2}n_{Al\left(OH\right)_3}=0,032\left(mol\right)\)
\(\Rightarrow m_{Al_2O_3}=0,032\cdot102=3,264\left(mol\right)\)

nKOH = 0,1.1,5 = 0,15 mol , nH3PO4 = 0,2.0,5 = 0,1 mol
T = \(\dfrac{nKOH}{nH_3PO_4}\)= \(\dfrac{0,15}{0,1}\)= 1,5 => tạo 2 muối \(\left\{{}\begin{matrix}H_2PO_4^-\\HPO_4^{2-}\end{matrix}\right.\)
KOH + H3PO4 ---> KH2PO4 + H2O
2KOH + H3PO4 ---> K2HPO4 + 2H2O
Gọi số mol KH2PO4 và K2HPO4 lần lượt là x và y , theo tỉ lệ phản ứng ta có
\(\left\{{}\begin{matrix}x+y=0,1\\x+2y=0,15\end{matrix}\right.\)=> x = 0,05 và y = 0,05
mKH2PO4 = 0,05. 136 = 6,8 gam , mK2HPO4 = 0,05 . 174 = 8,7 gam.

Dễ dàng thấy chất tan là CuSO4 = 0,02 mol (bảo toàn nguyên tố Cu)
=> Quy đổi ban đầu có 0,02 mol S (bảo toàn nguyên tố S) và 0,02 mol Cu
Bảo toàn e => n NO2 = 0,02.6 + 0,02.2 = 0,16 mol
QT cho e :
Cu → Cu2++ 2e
0,02 0,04 mol
S0 → SO42-+ 6e
0,02 0,12 mol
Số mol e cho là ne cho= 0,16 mol
Theo bảo toàn e : ne cho= ne nhận= 0,16 mol
QT nhận e :
N+5+ 1e → NO2
0,16 → 0,16 mol
2NaOH + 2NO2 => NaNO2 + NaNO3 + H2O
Do 0,2> 0,16 nên NO2 hết và NaOH dư
Vì NO2 hết nên n H2O = 0,08 mol (= ½ n NO2)
=> m chất rắn = mNO2+ mNaOH- mH2O= 40.0,2 + 0,16.46 – 0,08.18 = 13,92 gam
Đáp án C
ta có : \(\dfrac{Zn}{\dfrac{0,01}{\dfrac{0,01}{0}}}+\dfrac{2HCl}{\dfrac{0,04}{\dfrac{0,02}{0,02}}}\rightarrow ZnCl_2+H_2\)
\(\Rightarrow\) \(\dfrac{HCl}{0,02}\rightarrow\dfrac{H^+}{0,02}+Cl^-\)
\(\Rightarrow\left[H^+\right]=\dfrac{0,02}{0,2}=0,1\) \(\Rightarrow pH=-\log_{10}\left[H^+\right]=-\log_{10}\left[0,1\right]=1\)
vậy \(pH\) của dung dịch sau phản ứng là \(1\)