Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
a) Ta có: \(n_{SO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_{Fe}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{\dfrac{1}{15}\cdot56}{13,6}\cdot100\%\approx27,45\%\) \(\Rightarrow\%m_{CuO}=72,55\%\)
b) Ta có: \(m_{CuO}=13,6-\dfrac{1}{15}\cdot56\approx9,9\left(g\right)\) \(\Rightarrow n_{CuO}=n_{H_2SO_4}=\dfrac{9,9}{80}=0,12375\left(mol\right)\)
*Làm gì có H2SO4 loãng đâu nhỉ ??

\(n_{Fe}=a\left(mol\right),n_{FeO}=b\left(mol\right)\)
\(m_X=56a+72b=12.8\left(g\right)\)
\(n_{H_2}=n_{Fe}=\dfrac{2.24}{22.4}=0.1\left(mol\right)\)
\(\Rightarrow a=0.1\)
\(b=\dfrac{12.8-56\cdot0.1}{72}=0.1\left(mol\right)\)
\(BTe:\)
\(3n_{Fe}+n_{FeO}=2n_{SO_2}\)
\(\Rightarrow n_{SO_2}=\dfrac{3\cdot0.1+0.1}{2}=0.2\left(mol\right)\)
\(V_{SO_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(\)

Đáp án A
Các phương trình phản ứng:
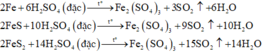
Tính toán:
Qui đổi hỗn hợp ban đầu thành Fe và S. Ta có:

Sơ đồ phản ứng:
Fe 0 ⏟ 0 , 3 mol S 0 ⏟ 0 , 3 mol + H 2 S + 6 O 4 ( đ ặ c ) → t 0 F e + 3 2 ( SO 4 ) 3 + S + 4 O 2 ⏟ 2 mol + H 2 O
Các quá trình nhường, nhận electron:


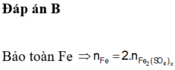
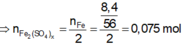
![]()
![]()
![]()
![]()
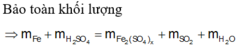
=> 8,4+0,4.98=0,075(56.2+96x)+(0,4-0,075x).64+0,4.18
=> x=8/3
m_muối=0,075(56.2+96.8/3)=27,6 gam
![]()
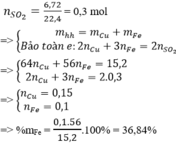

Áp dụng bảo toàn e :
=> 2nCu + 3nFe = 2.nSO2
=> nSO2 = (2.0,25+3.0,3)/2 = 0,7 mol
=> V=0,7.22,4=15,68 lít