Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Fe(OH)3+3H2SO4(loãng)→ Fe2(SO4)3+ 6H2O
(mol) 0,15 0,225
\(n_{Fe\left(OH\right)_3}=\dfrac{m}{M}=\dfrac{16,05}{107}=0,15\left(mol\right)\)
\(->m_{H_2SO_4}=n.M=0,225.98=22,05\left(g\right)\)
Ta có:
\(C\%=\dfrac{m_{H_2SO_4}}{m_{ddH_2SO_4}}.100\%=7,35\%\)
<=> \(m_{ddH_2SO_4}=\dfrac{22,05.100}{7,35}=300\left(g\right)\)
Chọn câu: A

a) nFe= 16/56 =~ 0,3 mol
mH2S04 =( C% .mdd ) /100%= ( 20.100) /100 = 20g
nH2SO4 = 20/98 =~ 0,2mol
lập pthh của pu
Fe + H2SO4 ----------> FeSO4 + H2
1mol 1mol 1mol 1mol
0,3mol 0,2mol
xét tỉ lệ nFe dư sau pư vậy tính theo mol H2SO4
nFe (pư) = (0,2 .1 )/1 =0,2mol
nFe (dư) = 0,3 -0,2 =0,1mol
mFe dư = 0,1 . 56 = 5,6 g
mFeSO4 = 0,2 .152 = 30,4 g
b) mdd sau pư = mFe + m dung môi = 16 +100=116 g
c% Fe = (5,6 / 116) .100%=~ 4,83%
c% FeSO4 =(30,4/116).100%=~ 26,21%
a) đối 200ml =0,2 lít
CMFe =n/v = 0,1 / 0,2 =0,5 mol/lít
CMFeSO4 =n/v = 0,2/0,2=1 mol /lít

\(n_{Fe_2O_3}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2SO4 --> Fe2(SO4)3 + 3H2O
______0,05------>0,15--------->0,05
=> mH2SO4 = 0,15.98 = 14,7(g)
=> \(C\%\left(H_2SO_4\right)=\dfrac{14,7}{100}.100\%=14,7\%\)
\(C\%\left(Fe_2\left(SO_4\right)_3\right)=\dfrac{0,05.400}{8+100}.100\%=18,52\%\)
PTHH: Fe2(SO4)3 + 6NaOH --> 2Fe(OH)3\(\downarrow\) + 3Na2SO4
________0,05----------------------->0,1
=> mFe(OH)3 = 0,1.107=10,7(g)

1 Gọi công thức oxit của kim loại hóa trị III là A2O3,ta có các phương trình sau
A2O3+3H2SO4--->A2(SO4)3+3H2O (1)
0,02 0,06 0,02
Vì sau phản ứng (1) dung dịch còn có thể phản ứng với CaCO3 giải phóng khí CO2=>axit H2SO4 dư,ta có phương trình
H2SO4+CaCO3--->CaSO4+CO2+H2O (2)
0,01 0,01 0,01 0,01
nCO2=0,224:22,4=0,01 mol
Khối lượng muối A2(SO4)3 sau khi cô cạn là
9,36-0,01x(40+96)=8 g
Ta thấy rằng A2O3=3,2 g,sau phản ứng tạo thành muối A2(SO4)3=8g Như vậy khối lượng tăng thêm là do 3 gốc -SO4 thay thế cho 3 nguyên tử Oxi,vậy khối lượng tăng thêm là 8-3,2 =4,8 g
nA2SO4=4,8:(96x3-16x3)=0,02 mol
=>khối lượng muối=0,02x(2xR+96x3)=8
=>R=56
R hóa trị III, có M=56=>R là Fe,công thức oxit là Fe2O3
nH2SO4=0,01+0,06=0,07 mol
mH2SO4=0,07x98=6,86g
C% dd H2SO4=(6,86:200)x100%=3,43%
2.
nH2O = 0.25 mol => nH2 = 0.25 mol
=> nH2/ B = 0.5 mol => nH+ = 1 mol = nHCl pứ = nCl- ( H+ + Cl- = HCl )
=> mCl- = 35.5g => m muối A = 35.5 + 18.4 = 53.9g
b/ m ( dd NaOH ) = 240g => m NaOH = 48g => n NaOH = 1.2 mol
H2 + Cl2 ---> 2HCl
0.5 1
NaOH + HCl --> NaCl + H2O
1 1 1 1
Khối lượng dd lúc này: 1*36.5 + 240 = 276.5 gam
mNaCl tạo thành = 58.5g => C% NaCl = 21.15%
%NaOH dư = ( 1.2 - 1 ) * 40 / 276.5 = 2.89%
c/ Gọi khối lượng mol của KL nhẹ hơn ( A ) là x => khối lượng mol của KL còn lại ( B ) là 2.4 * x
Vì số mol của 2 KL bằng nhau và bằng a mol
=> 3a + 2a = 5a = 1 mol => a = 0.2 mol ( KL hóa trị III td với 3 mol HCl, KL hóa trị II td 2 mol HCl )
=> 0.2*x + 0.2*2.4*x = 18.4 => x = 27.
A: Al
B: Zn
Anh giải đặt ẩn nhiều,trông hơi khó coi nên em trình bày cho đẹp nha!!

a) PTHH: Fe2O3 + 3H2SO4 ➜ Fe2(SO4)3 + 3H2O
b) \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(m_{H_2SO_4}=500.98\%=49\left(g\right)\)
⇒ \(n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
Theo PT: \(n_{Fe_2O_3}=\dfrac{1}{3}n_{H_2SO_4}\)
Theo bài: \(n_{Fe_2O_3}=\dfrac{1}{5}n_{H_2SO_4}\)
Vì \(\dfrac{1}{5}< \dfrac{1}{3}\) ⇒ Fe2O3 hết, H2SO4 dư
Theo PT: \(n_{Fe_2\left(SO_4\right)_3}=n_{Fe_2O_3}=0,1\left(mol\right)\)
⇒ \(m_{Fe_2\left(SO_4\right)_3}=0,1.400=40\left(g\right)\)
c) Dung dịch sau phản ứng gồm: H2SO4 dư và Fe2(SO4)3
\(n_{H_2SO_4}pư=3n_{Fe_2O_3}=3.0,1=0,3\left(mol\right)\)
⇒ \(n_{H_2SO_4}dư=0,5-0,3=0,2\left(mol\right)\)
⇒ \(m_{H_2SO_4}dư=0,2.98=19,6\left(g\right)\)
\(m_{dd}=16+500=516\left(g\right)\)
\(C\%_{dd_{H_2SO_4}}=\dfrac{19,6}{516}.100\%=3,8\%\)
\(C\%_{Fe_2\left(SO_4\right)_3}=\dfrac{40}{516}.100\%=7,75\%\)

a) PTHH: CuO + H2SO4 → CuSO4 + H2O (1)
b) \(n_{CuO}=\dfrac{16}{80}=0,2\left(mol\right)\)
Theo PT1: \(n_{H_2SO_4}=n_{CuO}=0,2\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4}=0,2\times98=19,6\left(g\right)\)
\(\Rightarrow C\%_{ddH_2SO_4}=\dfrac{19,6}{400}\times100\%=4,9\%\)
c) Theo PT1: \(n_{CuSO_4}=n_{CuO}=0,2\left(mol\right)\)
\(\Rightarrow m_{CuSO_4}=0,2\times160=32\left(g\right)\)
\(\Sigma m_{dd}=16+400=416\left(g\right)\)
\(\Rightarrow C\%_{ddCuSO_4}=\dfrac{32}{416}\times100\%=7,69\%\)
d) CuSO4 + BaCl2 → BaSO4↓ + CuCl2 (2)
Theo PT2: \(n_{BaSO_4}=n_{CuSO_4}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=0,2\times233=46,6\left(g\right)\)
Vậy m=46,6

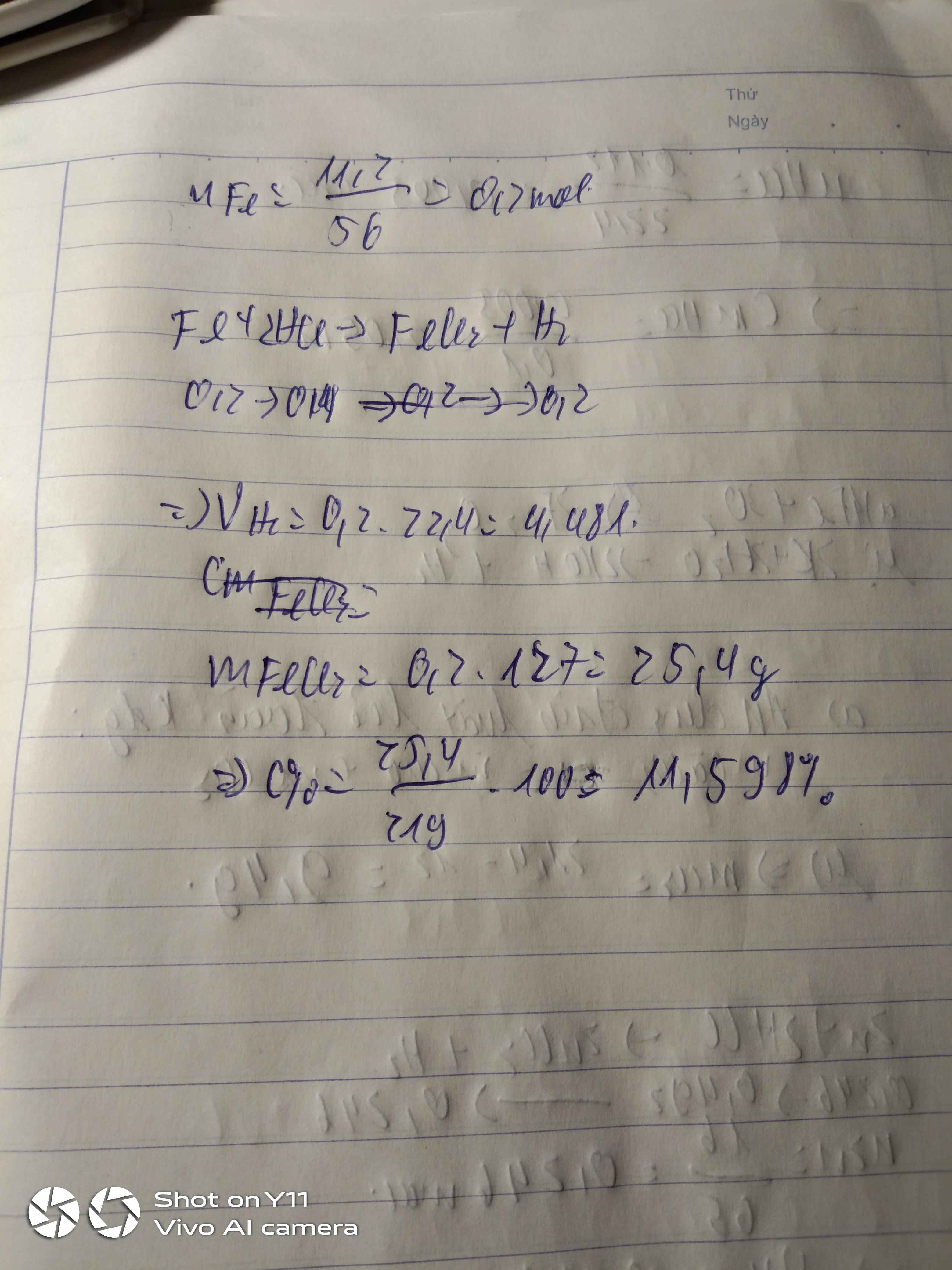
B