Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có : \(56n.Fe+M.n_H=11,12\left(\odot\right)\)
Phần 1 :
Bảo toàn e : \(2.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_H\)
\(=2.\frac{3,136}{22,4}=0,26\left(1\right)\)
( n là hóa trị của M )
Phần 2 :
Bảo toàn e : \(3.\frac{n_{Fe}}{2}+n.\frac{n_M}{2}=2.n_{SO2}=2.\frac{4,042}{22,4}\approx0,36\left(2\right)\)
Từ ( 1) và ( 2) \(\rightarrow\frac{n_{Fe}}{2}=0,36-0,28=0,08\left(mol\right)\)
\(\rightarrow n_{Fe}=0,16\left(mol\right)\)
Thay \(\left(\odot\right)\) vào \(\left(1\right)\)
\(\Leftrightarrow\left\{{}\begin{matrix}56.0,16+M.n_M=11,12\\2.0,08+n.\frac{n_M}{2}=0,28\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}n_M=\frac{2,16}{M}\\n_M=\frac{0,24}{n}\end{matrix}\right.\rightarrow\frac{2,16}{M}=\frac{0,24}{n}\)
\(\rightarrow M=\frac{0,16.n}{0,24}=9n\)
Lập bảng :
| n | 1 | 2 | 3 |
| M | 9 | 18 | 27 |
| KL | Loại | Loại | Al |
Vậy M là Al
\(\rightarrow m_{Fe}=56.0,16=8,96\left(g\right)\)
\(\%m_{Fe}=\frac{8,96}{11,12}.100\%=80,58\%\)
\(\%m_{Al}=100\%-80,58\%=19,42\%\)

Đáp án D
Các phản ứng
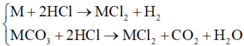
Do đó hỗn hợp khí A thu được gồm H2 và CO2.
Gọi
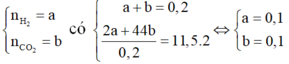
![]()
M = 24 là Mg.

Đáp án D
Các phản ứng
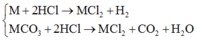
Do đó hỗn hợp khí A thu được gồm H2 và CO2.
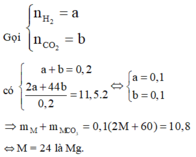

Chọn B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol; M C O 3 = b m o l .


Qui hh thành kim loại M a mol => Ma = 12,34 g
2 M + n H2SO4 -> M2(SO4)n + n H2
a-----------------------------0,5a------------0,5na
Mol H2 = 0,5na = 0,2 => na = 0,4
m muối = 0,5a(2M + 96n) = Ma + 48na = 31,54

Gọi X là kim loại trung bình:
\(X+H_2SO_4\rightarrow XSO_4+H_2\)
\(n_X=\dfrac{2}{X}\left(mol\right);n_{XSO_4}=\dfrac{8,72}{X+96}\left(mol\right)\)
Theo pt: nX = nXSO4
\(\Rightarrow\dfrac{2}{X}=\dfrac{8,72}{X+96}\)
\(\Rightarrow X=29\)
Vì 2 kim loại ở 2 chu kì liên tiếp và thuộc nhóm IIA
Vậy 2 kim loại là Mg và Ca