Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn nguyên tố: \(n_{H_2SO_4}=n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{H_2}=0,5\cdot2=1\left(g\right)\\m_{H_2SO_4}=0,5\cdot98=49\left(g\right)\end{matrix}\right.\)
Bảo toàn khối lượng: \(m_{muối}=m_{KL}+m_{H_2SO_4}-m_{H_2}=68,2\left(g\right)\)

Đáp án A
Gọi M là kim loại chung cho Zn và Mg với hóa trị n
Sơ đồ phản ứng: M + H 2 SO 4 ( loãng , dư ) → M 2 ( SO 4 ) n ⏟ muối + H 2 ↑
Khí thu được là
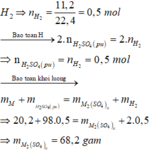

PTHH: Mg + H2SO4 ===> MgSO4 + H2
Zn + H2SO4 ===> ZnSO4 + H2
Ta có: nH2 = \(\frac{6,72}{22,4}=0,3\left(mol\right)\)
=> mH2 = 0,3 x 2 = 0,6 (gam)
Theo PTHH, ta thấy nH2SO4 = nH2 = 0,3 (mol)
=> mH2SO4 = 0,3 x 98 = 29,4 (gam)
Áp dụng định luật bảo toàn khối lượng, ta có:
mmuối khan = mkim loại + mH2SO4 - mH2 = 11,3 + 29,4 - 0,6 = 40,1 (gam)

\(n_{Zn}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+H_2\)
\(n_{H_2}=a+1.5b=0.4\left(mol\right)\left(1\right)\)
\(m_{Muối}=m_{ZnCl_2}+m_{AlCl_3}=136a+133.5b=40.3\left(g\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.2\)
\(m_{hh}=0.1\cdot65+0.2\cdot27=11.9\left(g\right)\)
\(\%Zn=\dfrac{0.1\cdot65}{11.9}\cdot100\%=54.62\%\)
\(\%Al=100-54.62=45.38\%\)

Đáp án A
Chất rắn Y là Cu không phản ứng
nHCl = ![]() = 2.0,35 = 0,7
= 2.0,35 = 0,7
mmuối = mKL + mgốc axit = (9,14 – 2,54) + 0,7.35,5 = 31,45(g)

Đáp án D
Khí thu được là H2 : n H 2 = 13 , 44 22 , 4 = 0 , 6 mol
Gọi M là kim loại chung cho Mg, Fe và Zn với hóa trị n
Sơ đồ phản ứng :
![]()
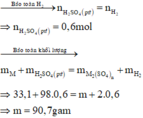

Đáp án D
Số mol H2 thu được là : n H 2 = 11 , 2 22 , 4 = 0 , 5 mol
Gọi M là kim loại chung cho Al và Mg với hóa trị n
Sơ dồ phản ứng :
M ⏟ 10 , 2 gam + H 2 S O 4 ( l o ã n g , d ư ) → M 2 ( S O 4 ) n ⏟ m u ố i + H 2 ↑ ⏟ 0 , 5 m o l
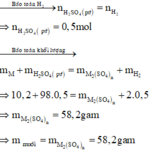

Ta có: \(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
BTNT, có: \(n_{SO_4}=n_{H_2SO_4}=n_{H_2}=0,6\left(mol\right)\)
Mà: m muối = mKL + mSO4
⇒ m = mKL = 93,6 - 0,6.96 = 36 (g)
Bạn tham khảo nhé!

\(19,1gam\) \(:\left\{{}\begin{matrix}Al\\Mg\\Zn\end{matrix}\right.\)\(\underrightarrow{+O_2}\)\(Y:25,5gam\)\(\underrightarrow{+HCl}\left\{{}\begin{matrix}AgCl_3\\MgCl_2\\ZnCl_2\end{matrix}\right.\) + H2 : 0,3 mol
H2O
Áp dụng định luật bảo toàn khối lượng:
\(mO_2=25,5-19,1=6,4gam\) \(\Rightarrow nO_2=0,2\left(mol\right)\)
BTNT O : nH2O = 0,4mol
\(\rightarrow nHCl^-\left(tdOxi\right)=0,8\left(mol\right)\)
\(nH_2=0,3\left(mol\right)\rightarrow nCl^-\left(tdKl\right)=0,6\left(mol\right)\)
\(m_{muối}=19,1+\left(0,8+0,6\right).35,5=68,8\left(g\right)\)
Gọi \(a,b\) lần lượt là số mol của Mg và Zn
Theo đề, ta có PTHH:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\left(1\right)\)
\(a----------->a\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\left(2\right)\)
\(b----------->b\)
mhỗn hợp\(=24a+65b=11,3\left(g\right)\left(3\right)\)
\(n_{H_2}=a+b=\frac{6,72}{22,4}=0,3\left(mol\right)\left(4\right)\)
Từ \(\left(3\right),\left(4\right)\) ta có hệ:\(\left\{{}\begin{matrix}24a+65b=11,3\\a+b=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\)
mmuối khan \(=m_{MgSO_4}+m_{ZnSO_4}=120.0,2+161.0,1=40,1\left(g\right)\)
Cách 2:
Áp dụng định luật bảo toàn nguyên tố [H], ta có:
\(n_{H_2SO_4}=n_{H_2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
\(\Rightarrow m_{H_2SO_4\left(p.ư\right)}=0,3.98=29,4\left(g\right)\)
Áp dụng định luật bảo toàn khối lượng, ta có:
mkim loại + mdung dịch H2SO4 phản ứng = mmuối khan + mkhí
\(\Leftrightarrow11,3+29,4=m\)muối\( +0,3.2\)
\(\Leftrightarrow m\)muối \(=40,1\left(g\right)\)