Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi số mol của Fe và FeS lần lượt là x và y
a) \(Fe+2HCl->FeCl_2+H_2\)
x.........................................x
\(FeS+2HCl->FeCl_2+H_2S\)
y............................................y
b) ta có n A = x+y = 6,72:22,4=0,3 mol
ta lại có m X = 56x+ 88y = 23,2 g
=> x=0,1 mol y=0,2 mol
=> m Fe = 0,1. 56 =5,6 g
% Fe = \(\dfrac{5,6}{23,2}.100\sim24,14\%\)
=> %FeS = \(100\%-24,14\%\sim75,86\%\)
c) V H2 = 0,1.22,4=2,24 lít
=> % H2 = \(\dfrac{2,24}{6,72}.100\sim33,34\%\)
% H2S = 100%-33,34%∼66,67%

a) PTHH: 2Al + 6 HCl -> 2 AlCl3 + 3 H2
x___________3x______________1,5x(mol)
Fe +2 HCl -> FeCl2 + H2
y___2y____y______y(mol)
b) Ta có: m(rắn)= mCu=0,4(g)
=> m(Al, Fe)=1,5-mCu=1,5-0,4=1,1(g)
nH2= 0,04(mol)
Ta lập hpt:
\(\left\{{}\begin{matrix}27x+56y=1,1\\1,5x+y=0,04\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,02\\y=0,01\end{matrix}\right.\)
=> mAl=27.0,02=0,54(g)
mFe=56.0,01=0,56(g)

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
____0,05<------------------------0,05
=> mFe = 0,05.56 = 2,8 (g)
=> mCu = 6 - 2,8 = 3,2 (g)
=> D

\(n_{H_2}=\dfrac{V_{H_2}}{22,4}=\dfrac{1,68}{22,4}=0,075mol\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,15 0,075 0,075 ( mol )
\(V_{HCl}=\dfrac{n_{HCl}}{C_{M\left(HCl\right)}}=\dfrac{0,15}{0,5}=0,3l=300ml\)
\(m_{FeCl_2}=n_{FeCl_2}.M_{FeCl_2}=0,075.127=9,525g\)

\(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
Gọi số mol Al, Fe là a, b
=> 27a + 56b = 2,78
2Al + 6HCl --> 2AlCl3 + 3H2
a------------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b--------------->b----->b
=> 1,5a + b = 0,07
=> a = 0,02; b = 0,04
=> mFeCl2 = 0,04.127 = 5,08 (g)
=> C

Có V1 < V2 => khi X tác dụng với H2O thì Al còn dư.
Giả sử số mol 3 kim loại là: x, y, z.
K + H2O → KOH + ½ H2↑
x → x 0,5x
Al + KOH + H2O → KAlO2 + 1,5H2↑
x ← x→ 1,5x
→ 0,5x + 1,5x = 0,2 → x = 0,1
X tác dụng với KOH: 0,1 . 0,5 + 1,5y = 0,35 => y = 0,2
Khi cho X tác dụng với H2O còn dư Al => Y chứa Al dư và Fe
nAl dư = nAl ban đầu – nAl phản ứng = 0,2 – 0,1 = 0,1mol
=> 0,1 . 1,5 + z = 0,4 => z = 0,25mol
=> m = 23,3g

\(Fe+2HCl\rightarrow FeCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Đặt:\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}56x+27y=2,78\\x+1,5y=0,07\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,04\\y=0,02\end{matrix}\right.\\ n_{FeCl_2}=n_{Fe}=0,04\left(mol\right)\\ \Rightarrow m_{FeCl_2}=0,04.127=5,08\left(g\right)\)
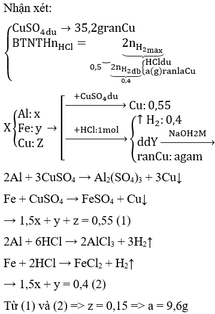
PTHH:
Fe + 2HCl ---> FeCl2 + H2
Cu + HCl ---x--->
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow\%_{m_{Fe}}=\dfrac{5,6}{10}.100\%=56\%\)
\(\%_{m_{Cu}}=100\%-56\%=44\%\)