
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


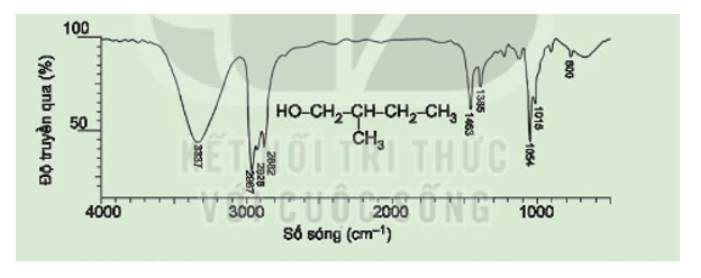
Số sóng hấp thụ đặc trưng của nhóm –OH là 3337 cm-1

CH3COONa(aq) + H2O(l) ⇌ CH3COOH(aq) + NaOH(aq)
Hiện tượng: Khi đun nhẹ bình (1), dung dịch trong bình (1) hóa hồng.
Nhận xét: Sau khi đun nhẹ, phản ứng thủy phân diễn ra tạo NaOH làm hoa hồng chỉ thị phenolphthalein.

- Bước 2: để yên một thời gian, hỗn hợp trong phễu tách lớp. Tinh dầu quýt tan trong hexane, nước không ta trong hexane, do đó sau một thời gian sẽ có hiện tượng tách lớp: một lớp nước nặng hơn ở dưới và một lớp gồm hỗn hợp hexane, tinh dầu quýt nhẹ hơn ở trên.
- Bước 3: vặn khoá phễu từ từ, lớp nước phía dưới chảy vào bình tam giác, lớp trên là hỗn hợp hexane và tinh dầu quýt được lấy ra khỏi phễu bằng
- Bước 4: Làm bay hơi hexane để thu được tinh dầu quýt. Hexane có nhiệt độ sôi thấp hơn tinh dầu quýt, do đó khi làm bay hơi hỗn hợp, hexane bay hơi trước, còn lại tinh dầu quýt.

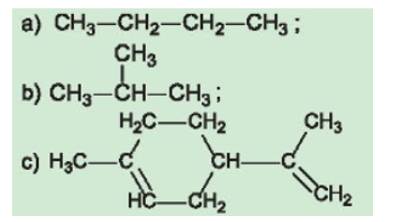
a) Mạch hở không phân nhánh;
b) Mạch hở phân nhánh;
c) Mạch vòng, có nhánh.

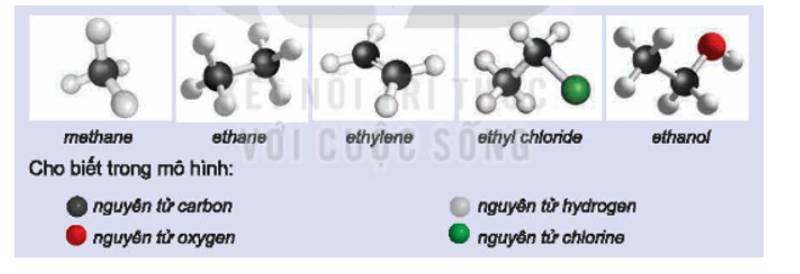
Methane: CH4;
Ethane: C2H6;
Ethylene: C2H4;
Ethyl chloride: C2H5Cl;
Ethanol: C2H6O.

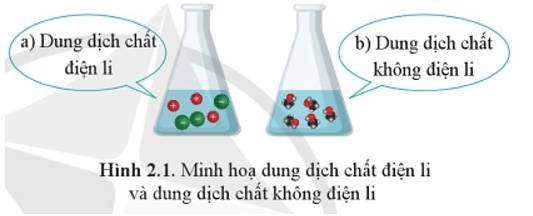
Sự khác nhau giữa chất điện li và chất không điện li:
+ Chất điện li là chất khi tan trong nước phân li thành ion.
+ Chất không điện li là chất khi tan trong nước không phân li thành ion.

tham khảo.
Hiện tượng: Cây nên đang cháy bị tắt khi đặt trong bình kín chứa khí nitrogen.
Giải thích: Khí nitrogen không có khả năng duy trì sự cháy.

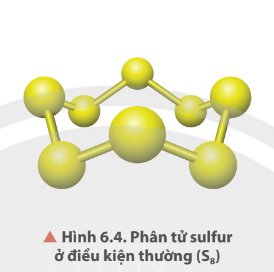
Ở dạng phân tử, sulfur gồm 8 nguyên tử liên kết cộng hoá trị với nhau tạo thành mạch vòng.





Câu 35:
\(M_{khí}=7,3.4=29,2\left(g/mol\right)\)
Khí hoá nâu ngoài không khí => Khí đó là NO
\(n_{khí}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
=> \(m_{khí}=0,05.29,2=1,46\left(g\right)\)
\(n_{HNO_3}=1,15.0,4=0,46\left(mol\right)\)
BTNT H: \(n_{H_2O}=\dfrac{1}{2}n_{HNO_3}=0,23\left(mol\right)\)
Áp dụng ĐLBTKL:
m + mHNO3 = mmuối + mkhí + mH2O
=> m = 44,82 + 1,46 + 0,23.18 - 0,46.63 = 21,44 (g)
Câu 36:
\(n_{khí}=\dfrac{2,688}{22,4}=0,12\left(mol\right)\)
Áp dụng sơ đồ đường chéo, ta có:
\(\dfrac{n_{NO}}{n_{NO_2}}=\dfrac{46-\dfrac{55}{3}.2}{\dfrac{55}{3}.2-30}=\dfrac{7}{5}\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,07\left(mol\right)\\n_{NO_2}=0,05\left(mol\right)\end{matrix}\right.\)
Gọi hoá trị của M là n
Quá trình oxi hoá - khử:
\(M^0-ne\rightarrow M^{+n}\\ N^{+5}+1e\rightarrow M^{+4}\\ N^{+5}+3e\rightarrow N^{+2}\)
BTe: \(n_M=\dfrac{3n_{NO}+n_{NO_2}}{n}=\dfrac{0,26}{n}\left(mol\right)\)
=> \(M_M=\dfrac{8,32}{\dfrac{0,26}{n}}=32n\left(g/mol\right)\)
Với n = 2 thoả mãn => MM = 32.2 = 64 (g/mol)
=> M là Cu
Câu 35
T gồm NO ( khí ko màu hóa nâu trong kk) và N2 (vì 30>29,2 nên khí còn lại phải có phân tử khối nhỏ hơn 29,2 loại khí N20)
Áp dụng quy tắc đường chéo
NO 30 1,2 3
29,2
N2 28 0,8 2
nhh khí =1,12:22,4=0,05 mol ⇒ nNO =0,03 mol và nN2 =0,02 mol
CT tính số mol HNO3 nhanh
nHNO3 =4nNO +12nN2 +10nNH4NO3
⇒nNH4NO3 =0,01 mol
mt =mKl +62ne+mNH4No3 =44,82 g thay số vào ta được mKL= 21,08 g