
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!




Đặt CTHH của oxit sắt cần tìm : FexOy
PTHH : FexOy + yH2 = xFe + yH2O
0.2
Theo giả thiết C%H2SO4 còn 98% -3.405%= 94.595%
Hoặc \(\dfrac{98}{100+m_{H2O}}\) =0.94595
giải được mH2O=3.6g
nH2O=0.2 mol
Chất rắn thu được là Fe , nH2 thoát ra=3.36/22.4=0.15 mol
PTHH : Fe + H2SO4 --> FeSO4 + H2
0.15 0.15
Ta có tỉ lệ : nFe:nH2O = x:y = 0,15:0,2 = 3:4
Vậy CTHH của oxit sắt là Fe3O4


A là dung dịch H2SO4
B: Na2CO3
C: H2SO4 đặc
D: Xút (NaOH)
Khi cho DD H2SO4 tác dụng với Na2CO3 giải phóng khí SO2 mang theo hơi nước.
Bình C để giữ hơi nước lại trong bình (H2SO4 đặc háu nước) SO2 không tác dụng tiếp tục được dẫn qua bình đựng.
Để tránh SO2 thoát ra bên ngoài gây ô nhiễm môi trường và 1 số bệnh cho con người nên Xút được đặt ở miệng bình để tạo muối.


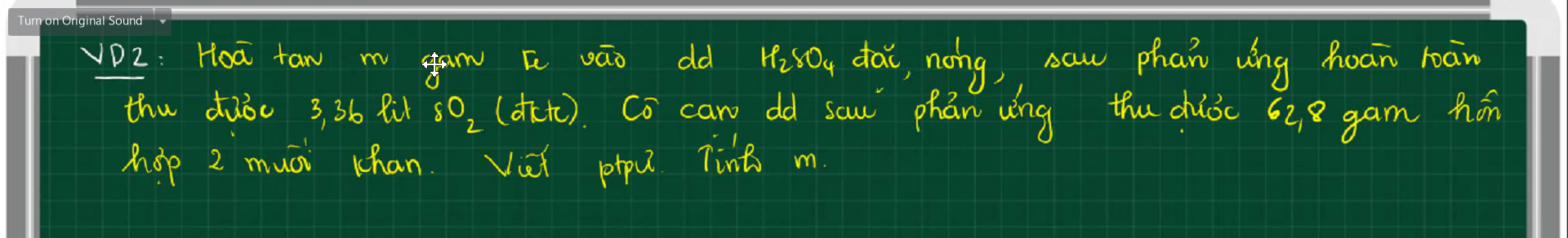




 Giúp hộ mình nha !!!
Giúp hộ mình nha !!! Giúp mình nha !!!
Giúp mình nha !!!


\(m_{dd\left(80^oC\right)}=1026,4\left(g\right)\)
Gọi khối lượng M2SO4 trong dd bão hòa ở 80oC là a(g)
Có \(S_{80^oC}=\dfrac{a}{1026,4-a}.100=28,3\left(g\right)\)
=> a = 226,4 (g)
\(m_{H_2O\left(80^oC\right)}=1026,4-226,4=800\left(g\right)\)
Gọi khối lượng M2SO4 trong dd bão hòa ở 10oC là x (g)
Gọi khối lượng H2O trong dd bão hòa ở 10oC là y (g)
Có \(S_{10^oC}=\dfrac{x}{y}.100=9\left(g\right)\)
=> x = 0,09y (1)
mM2SO4 (tách ra) = 226,4 - x (g)
mH2O (tách ra) = 800 - y (g)
=> 226,4 - x + 800 - y = 395,4 (2)
(1)(2) => \(\left\{{}\begin{matrix}x=52,1\left(g\right)\\y=578,9\left(g\right)\end{matrix}\right.\)
mM2SO4 (tách ra) = 226,4 - x = 174,3 (g)
=> \(n_{M_2SO_4}=\dfrac{174,3}{2.M_M+96}\left(mol\right)\)
=> \(n_{M_2SO_4.nH_2O}=\dfrac{174,3}{2.M_M+96}\left(mol\right)\)
=> \(M_{M_2SO_4.nH_2O}=2.M_M+96+18n=\dfrac{395,4}{\dfrac{174,3}{2.M_M+96}}\left(g/mol\right)\)
=> MM + 48 = 7,095n
Xét n = 8 => MM = 8,76 (loại)
Xét n = 9 => MM = 15,855 (Loại)
Xét n = 10 => MM = 23 (Na)
Xét n = 11 => MM = 30,045 (Loại)
Vậy CT của muối ngậm nước là Na2SO4.10H2O
+) Ở $80^oC:$
100g nước có 23,8g chất tan
128,3g dung dịch có 28,3g chất tan
1026,4g dung dịch có $x(g)$ chất tan
$\to x=\dfrac{1026,4.28,3}{128,3}=226,4(g)$
Khối lượng nước của dd ở $80^oC$ là: $1026,4-226,4=800(g)$
+) Ở $10^oC:$
100g nước có 9g chất tan
109g dung dịch có 9g chất tan
$(1026,4-395,4)g=631g$ dung dịch có $y(g)$ chất tan
$\to y=\dfrac{631.9}{109}\approx 52(g)$
Khối lượng nước của dd ở $10^oC$ là: $631-52=579(g)$
Khối lượng nước kết tinh: $800-579=221(g)$
Khối lượng $M_2SO_4$ kết tinh: $226,4-52=174,4(g)$
\(\underbrace{M_2SO_4}_{174,4}.\underbrace{nH_2O}_{221}\)
Mà $7<n<12$
\(\begin{array}{|c|c|c|}\hline n&8&9&10&11\\\hline M_2SO_4&111,36&127,8&142&156,2\\\hline\end{array}\)
Vì $M_{M_2SO_4}\in \mathbb{N}\to M_{M_2SO_4}=142$
$\to M_M=23(Na)$
Vậy muối là $Na_2SO_4.10H_2O$