Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình điều chế hiđro
CH4 + 2H2O -to, xt→ CO2 + 4H2
Phương trình loại khí oxi:
CH4 + 2O2 -to→ CO2 + 2H2O
Phương trình tống hợp amoniac:
N2 + 3H2 -450-500o, Fe, 200-300atm→ 2NH3

CH4 + 2H2O 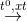 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk)  CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 ⇔ 2NH3

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 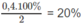
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

Đáp án B
Ta có trong 10 lít khí thiên nhiên có 9,6 lít CH4; 0,2 lít N2 và 0,2 lít CO2.
Đốt cháy khí thiên nhiên có phản ứng hóa học sau:
CH4 + 2O2 → t o CO2 + 2H2O
Ở cùng điều kiện nhiệt độ và áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol.
→ Cứ 9,6 lít CH4 phản ứng cần 9,6.2 = 19,2 lít O2.

Đáp án D
![]()
Vì ![]() nên N là anken
nên N là anken
Số nguyên tử C trong N là
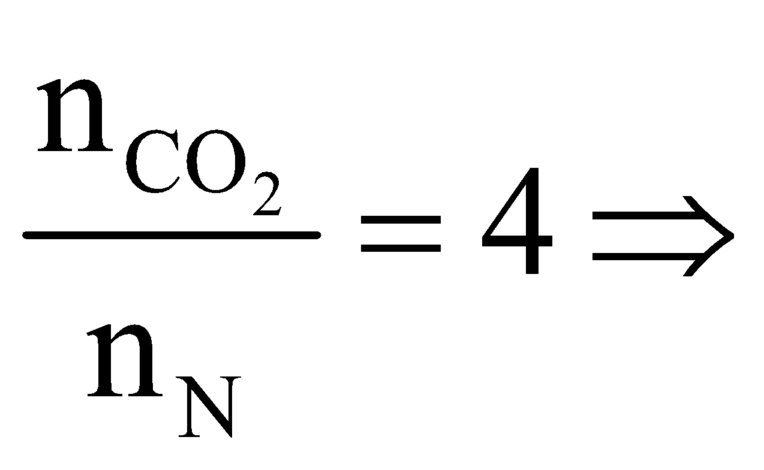 N là C4H8
N là C4H8
Khi đốt cháy N, hoặc P, hay Q đều cho số mol CO2 và H2O như nhau.
Suy ra N, P, Q đều là đồng phân của nhau và có cùng công thức phân tử là C4H8
Ta thấy đáp án A là phù hợp nhất khi tách hiđro tạo thành 3 sản phẩm là đồng phân của nhau

Nhiệt lượng cần để đun nóng 100 lít nước từ 20oC lên 100oC là:
4,18.(100 - 20).(100.103) = 33 440 000 (J) = 33 440 (kJ)
Gọi số mol khí thiên nhiên là x (mol)
⇒ nCH4 = 0,85x (mol) ; nC2H6 = 0,1x (mol)
Nhiệt lượng toả ra khi đốt cháy metan là: 880.0,85x = 748x (kJ)
Nhiệt lượng toả ra khi đốt cháy etan là: 15600.0,1x = 156x (kJ)
⇒ 748x + 156x = 33440
⇒ x = 36,991 (mol)
Vậy thể tích khí thiên nhiên cần dùng là:
36,991.22,4 = 828,6 (lít) (đktc)

CH4 + 2H2O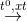 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk)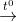 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 \(\Leftrightarrow\)2NH3
CH4 + 2H2O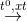 CO2 + 4H2
CO2 + 4H2
CH4 + 2O2 (kk)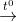 CO2 + 2H2O nên còn lại N2
CO2 + 2H2O nên còn lại N2
N2 + 3H2 ⇔ 2NH3