Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 5,6/56 = 0,1 (mol)
=> nFe2O3 = 0,1/2 = 0,05 (mol)
mFe2O3 = 0,05 . 160 = 8 (g)
=> C

\(Fe_xO_y\\ \%m_O=\frac{m_O}{m_{HC}}.100\%\\ \to 30\%=\frac{16y}{56x+16y}.100\%\\ \Rightarrow \frac{x}{y}=\frac{2}{3}\\ \Rightarrow Fe_2O_3\)

Fe2O3 =70%
=>m Fe3O4=\(\dfrac{700}{160}\)=4,375 mol
=>m Fe=4,375.56.2=490kg

Phương trình hóa học:
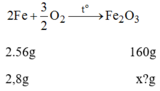
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
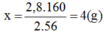
→ Chọn C.

\(m_{Fe_2O_3}=1,5\times90\%=1,35\left(tấn\right)\)
\(n_{Fe_2O_3}=\dfrac{1,35}{160}=0,0084375\left(mol\right)\)
Ta có: \(n_{Fe}=2n_{Fe_2O_3}=2\times0,0084375=0,016875\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,016875\times56=0,945\left(tấn\right)\)


nFe=0,1mol
2Fe2O3+6H2 -> 4Fe+6H2O ( đk nhiệt)
0,05 <- 0,1
mFe2O3=0,05.(56.2+16.3)=8g