Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

F e + 2 A g N O 3 → F e ( N O 3 ) 2 + 2 A g (0,25 điểm)
1 mol Fe phản ứng tạo thành 2 mol Ag thì khối lượng tăng thêm là: 2.108 – 56 = 160g (0,25 điểm)
Theo bài: m tăng = 57,6 – 56 = 1,6 g
⇒ n F e p ư = 1,6/160 = 0,1 mol
n A g = 2 . n F e = 0,1.2 = 0,2 mol
m A g = 0,2 .108 = 21,6 g (0,5 điểm)

a./ Khối lượng AgNO3 trong dd ban đầu: m(AgNO3) = 250.6% = 15g
Khối lượng AgNO3 pư: m(AgNO3 pư) = 17%.15 = 2,55g
→ n(AgNO3) = 2,55/170 = 0,015mol
2AgNO3 + Cu → 2Ag + Cu(NO3)2
0,015___0,0075_0,015__0,0075
Khối lượng của vật lấy ra sau pư:
m = 50 + m(Ag) - m(Cu pư) = 50 + 0,015.108 - 0,0075.64 = 51,14g
b./ Khối lượng các chất có trong dd sau pư:
m[Cu(NO3)2] = 0,0075.188 = 1,41g
m(AgNo3 dư) = m(AgNO3) - m(AgNO3 pư) = 15 - 2,55 = 12,45g
Khối lượng dd thu được:
m(dd) = m(dd AgNO3) + m(Cu pư) - m(Ag) = 250 + 0,0075.64 - 0,015.108 = 248,86g
Thành phần % các chất có trong dung dịch
%AgNO3 dư = 12,45/248,86 .100% = 5%
%Cu(NO3)2 = 1,41/248,86 .100% = 0,57%

\(n_{CuSO_4}=\dfrac{40.20}{100}:160=0,05\left(mol\right)\)
\(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
x x x x
Gọi x là số mol Fe pứ.
có: \(64x-56x=4,5-4,2=0,3\)
<=> 8x = 0,3
=> x = 0,0375
=> \(n_{Fe\left(pứ\right)}=n_{CuSO_{4\left(pứ\right)}}=n_{FeSO_{4\left(pứ\right)}}=x=0,0375\left(mol\right)\)
Vì: \(\dfrac{0,0375}{1}< \dfrac{0,05}{1}\) nên dd \(CuSO_4\) dư sau pứ là: \(0,05-0,0375=0,0125\left(mol\right)\)
Có: \(m_{dd}=4,2+40-4,5=39,7\left(g\right)\)
\(C\%_{dd.CuSO_{4\left(sau.pứ\right)}}=\dfrac{0,0125.160.100}{39,7}=5,04\%\)
\(C\%_{dd.FeSO_4}=\dfrac{0,0375.152.100}{39,7}=14,36\%\)

* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư. Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
P/ư: x x x x mol
Khối lượng lá sắt tăng = 2,58 - 2,5 = 0,08 gam. Ta có phương trình:
64x - 56x = 0,08
x = 0,01 mol
b) Sô mol CuS04 ban đầu = 0,02625 mol
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:
mdd = + mFe(p.ư) – mCu = 25.1,12 + 0,01.56 - 0,01.64 = 27,91 g
C%, CuS04 = .100% ≈ 9,32%
C%, FeSO4 = .100% ≈ 5,45%
* Nhận xét: “sau một thời gian phản ứng”, suy ra CuSO4 có thể vẫn còn dư.
Gọi số mol Fe phản ứng là x mol.
a) Phương trình hóa học:
Fe + CuSO4 → FeSO4 + Cu
1 mol Fe phản ứng thì khối lượng sắt tăng: 64-56 = 8 gam
x mol Fe → 2,58 -2,5 = 0,08 gam
⇒ x = 0,01 mol
b) Số mol CuSO4 ban đầu
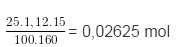
Trong dung dịch sau phản ứng có hai chất tan là FeSO4 0,01 mol và CuSO4 dư 0,01625 mol.
Khối lượng dung dịch:


Gọi x là số mol Zn p.ứ
Zn + CuSO4 = ZnSO4 + Cu
x x x (mol)
Vì khi phản ứng Zn tác dụng với CuSO4 và Cu bám trên bề mặt lá kẽm nên sau phản ứng ta thu được 49,82g khối lượng chất rắn gồm Zn dư và Cu
Ta có: 65x - 64x = 50 - 49,82 = 0,18(g)
=> x = 0,18 (mol)
Khối lượng CuSO4 trong dung dịch là
0,18 x 160 = 28,8 (g)

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
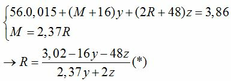
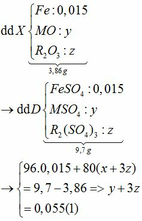
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%

nH2 = \(\frac{2,24}{22,4}\) = 0,1 (mol)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
0,1 <------------- 0,1 <--- 0,1 (mol)
a) mFe = 0,1 . 56 = 5,6 (g)
mCu = 4 (g)
b) mFeCl2 = 0,1 . 127= 12,7 (g)
c) Gọi nZn pư = x (mol)
Zn + FeCl2 \(\rightarrow\) ZnCl2 + Fe
x ----->x --------> x -------> x (mol)
Khối lượng CR giảm là khối lượng của sắt sinh ra.
=> 65x - 56x = 100 - 99,55
\(\Rightarrow\) x = 0,05
Sau pư thể tích ko đổi nên V = 0,1 (l)
CM(ZnCl22) = \(\frac{0,05}{0,1}\) = 0,5 (M)
nFeCl2 dư = 0,1 - 0,05 = 0,05 (mol)
CM(FeCl2) = \(\frac{0,05}{0,1}\) = 0,5 (M)

Tham khảo:
PTHH: Fe + CuSo4 ---->FeSo4 + Cu
Gọi a(mol) là số mol của Fe phản ứng
mCu - mFe = 3.5 - 2.3 = 1.2(g)
<--> 64a - 56a = 1.2
<--> 8a = 1.2
<--> a = 0.15
Dựa vào PTHH: nFe = nFeSo4 = 0.15(mol)
--> mFeSo4 = 0.15×152 = 22.8(g)

Fe + CuSO4 = FeSO4 + Cu
Sau phản ứng khối lượng thanh sắt tăng lên, chứng tỏ có 1 lượng Cu bám lên thanh sắt.
Khối lượng Cu phản ứng là: 16,4 - 15,6 = 0,8 (g)
Số mol Cu là: 0,8 : 64 = 0,0125 (mol)
Theo PTHH: n Fe= nCu = 0,0125 (mol)
Khối lượng sắt tham gia phản ứng là: 0,0125 x 56 = 0,7(g)
Khối lượng 1u là khoảng 1,6605.10-24 (g) , em cứ nhân lên là ra mấy thứ em cần tính nha!