Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.
BTKL ta có mX = mY => nX . MX = nY . mY
MX / My = nY / mY =0.75
Đặt nX = 1 mol => nY = 0,75 mol => nH2 phản ứng = 1 – 0,75 = 0,25mol
* TH hidrocacbon là anken: n anken = n H2 = 0,25 mol => n H2 trong X = 0,75 => M = (6,75 – 0,75 . 2)/0,25 = 21 (loại) * TH là ankin: => n akin = 0,25/2 = 0,125 => n H2 trong X = 0,875 mol => M = (6,75 – 0,875 . 2)/0,125 = 40 =>C3H4
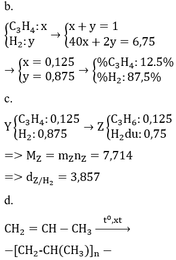


Gọi x là tỷ lệ số mol O2 trong hỗn hợp ban đầu
32x + 64 (1-x) = 48
x = (64 - 48)/(64 - 32) = 0,5 = 50%
Khi PTK của hỗn hợp tăng từ 48 lên 60 tức là thể tích giảm còn 80%, giảm 20% so với ban đầu.
thể tích giảm đi chính là thể tích O2 phản ứng.
vậy, thể tích O2 còn lại 30% so với ban đầu hay chiếm 30%/80% = 0,375 = 37,5% thể tích hỗn hợp sau phản ứng.
thể tích SO3 = 2 thể tích O2 phản ứng chiếm 40%/80% = 50% thể tích hỗn hợp sau phản ứng.
thể tích SO2 dư = 100% - 50% - 37,5% = 12,5% hỗn hợp sau phản ứng
2SO2+O2to,V2O5⇌2SO32SO2+O2⇌to,V2O52SO3
¯¯¯¯¯¯MX=24.2=48M¯X=24.2=48
Gọi a, b là mol SO2, O2
=> 64a+32ba+b=4864a+32ba+b=48
⇔16a=16b⇔16a=16b
Giả sử a=b=1a=b=1
%VSO2=%VSO3=1.1001+1=50%%VSO2=%VSO3=1.1001+1=50%
mX=mY=1.64+1.32=96gmX=mY=1.64+1.32=96g
¯¯¯¯¯¯MY=30.2=60M¯Y=30.2=60
=> nY=9660=1,6molnY=9660=1,6mol
Gọi 2x, x là mol SO2, O2 phản ứng
=> Y gồm 1-2x mol SO2, 1-x mol O2, 2x mol SO3
=> 1−2x+1−x+2x=1,61−2x+1−x+2x=1,6
⇔x=0,4⇔x=0,4
Y gồm 0,2 mol SO2, 0,6 mol O2, 0,8 mol SO3
%VSO2=0,2.1000,2+0,6+0,8=12,5%%VSO2=0,2.1000,2+0,6+0,8=12,5%
%VO2=0,6.1001,6=37,5%%VO2=0,6.1001,6=37,5%
%VSO3=50%

Có: nH2SO4 \(=\frac{4,9}{98}=0,05\left(mol\right)\)
Vì: \(x_1+H2S\text{O4}\rightarrow X_2+X_3\) nên X1 có thể là: oxit bazo, oxit lưỡng tính, bazo, hidroxit lưỡng tính, muối. Nhưng vì bài cho X1 có thể là CaO,MgO,NaOH,KOH,Zn và Fe nên loại các trường hợp oxit lưỡng tính, hidroxit lưỡng tính, muối.
TH1: X1 là oxit bazo: CaO,MgO.
Gọi CTPT chung cho X1 là MgO.
PTPU:
MO + H2SO4 → MSO4 + H2O (*) mol
0,05 0,05 0,05
Vậy KL mol của MO là: \(M_{MO}=\frac{2,8}{0,05}=56\left(g\right)\)
Vậy MO là CaO
TH2: Xét X1 là bazo: NaOH, KOH
Gọi CTPT chung cho X1 là MOH.
PTPƯ: 2MOH + H2SO4 → M2SO4 + 2H2SO4 (**)
0,1 0,05 0,05
Vậy KL mol của MOH là: \(M_{MOH}=\frac{2,8}{0,1}=28\left(g\right)\) (không có MOH thỏa mản)
TH3: X1 kim loại Zn và Fe. Gọi CTCP chung cho X1 là M.
PTPU: M + H2SO4 → MSO4 + H2 (***)
0,05 0,05 0,05
Vậy KL mol MO là \(M_M=\frac{2,8}{0,05}=56\left(g\right)\). Vậy M là Fe.
b. X1 là CaO thì X2 là \(m_{CaS\text{O4}}=0,05.136=6,8\left(g\right)\)
(khác bài ra 7,6 g) loại.
X1 là kim loại Fe thì X2 \(m_{FeS\text{O4}}=0,05.152=7,6\left(g\right)\) phù hợp với đề bài như vậy X3 là H2

a) nC = nCO2 = 8,8 : 44 = 0,2 mol => mC = 2,4g
nH = 2nH2O = 2.(5,4:18) = 0,6mol => mH = 0,6g
mC + mH = 2,4 + 0,6 = 3 = mA
=> Trong A không có oxi
nC : nH = 0,2 : 0,6 = 1 : 3
=> Công thức đơn giản: (CH3)n
Lại có \(d\dfrac{A}{H_2}=15\Rightarrow M_A=30\)
=> 15n = 30 => n = 2
=> Công thức phân tử: \(C_2H_6\)
b) 2C2H6 + 7O2 \(\xrightarrow[]{t^o}\) 4CO2 +6H2O

câu 1 lớp 8 thì viết pt là xong ,còn không thì qui đổi hh ,C+2O-->CO2(C dư phi lí nên ko phải lớp 8 đề sai
2. quì: tím||xanh||xanh|| tím(phân xanh và tím cho xanh vào tím
Ba(OH)2 vẫn ***c trắng|| || ||kt trắng
KOH vẫn ***c trắng|| || ||ko ht
Ca2++2OH- -->Ca(OH)2
Ba2++SO42- -->BaSO4
3. cho hh qua CaO dư (khó nhận biết) hoạc dùng cách khác sục hh khí qua Ca(OH)2 khí thu được tiếp tục cho qua CaOkhan ( loại bỏ H2O)
4.
CuSO4.5H2O-->CuSO4+5H2O
0.1875 0.1875
n=mdd*C%/(100*M)=0.1875
=>mCuSO4.5H2O=n*M=46.875g
BT klg:mH2Othêm=md*** rắn=153.125g

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)
a) Giả sử có 2 mol A, 3 mol B
=> \(\dfrac{2.M_A+3.M_B}{2+3}=22,4.2=44,8\)
=> 2.MA + 3.MB = 224
Mà \(\dfrac{M_A}{M_B}=1,0455\)
=> MA = 46, MB = 44
=> \(\left\{{}\begin{matrix}M_X+2M_Y=46\\2M_X+M_y=44\end{matrix}\right.=>\left\{{}\begin{matrix}M_X=14\\M_Y=16\end{matrix}\right.\) => X là N, Y là O
CTHH của A là NO2, của B là N2O
b)- \(n_{NO_2}=\dfrac{25,3}{46}=0,55\left(mol\right)=>n_O=0,55.2=1,1\left(mol\right)\)
=> \(m_O=1,1.16=17,6\left(g\right)\)
- \(n_{N_2O}=\dfrac{25,3}{44}=0,575\left(mol\right)=>n_O=0,575\left(mol\right)\)
=> mO = 0,575.16 = 9,2(g)
c) \(d_{NO_2/kk}=\dfrac{46}{29}=1,586\)
=> NO2 nặng hơn kk nên đặt đứng lọ
\(d_{N_2O/kk}=\dfrac{44}{29}=1,517\)
=> N2O nặng hơn kk nên đặt đứng lọ
E cảm ơn ạ!!