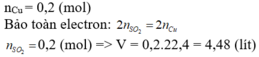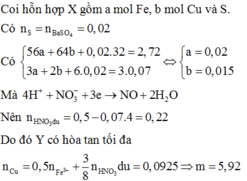Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tương tự như câu 54 nhưng chỉ nhận những ancol có 2 nhóm OH liền kề nhau
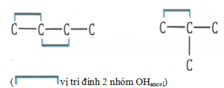
Lưu ý: ancol có khả năng hòa tan Cu(OH)2 ở điều kiện thường tạo dung dịch màu xanh thẫm cần thỏa mãn điều kiện có từ hai nhóm OHancol trở lên ở vị trí liền kề nhau.
Đáp án B

Cu ko td vs HCl.
Zn+2HCl=ZnCl2+H2
nH2=o.2 mol =nZn
mZn=0.2×65=13g
mCu=20-13=7g.
nHCl=2nH2=0.4mol.
VHCl=n\CM =0.8l

Chọn A
nCu = 12 , 8 64 = 0,2 (mol)
Bảo toàn electron: 2 n S O 2 = 2nCu
=> n S O 2 = nCu = 0,2 (mol) => V = 0,2.22,4 = 4,48 (lít)

Bài 5:
Ta có: mCu = 9 (g)
⇒ mAl + mFe = 20 - 9 = 11 (g)
Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 11 (1)
Ta có: \(n_{H_2}=0,4\left(mol\right)\)
Theo ĐLBT mol e, có: 3x + 2y = 0,4.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{20}.100\%=27\%\\\%m_{Fe}=\dfrac{0,1.56}{20}.100\%=28\%\\\%m_{Cu}=45\%\end{matrix}\right.\)
Bạn tham khảo nhé!
Bài 6:
Giả sử: \(\left\{{}\begin{matrix}n_{FeS}=x\left(mol\right)\\n_{ZnS}=y\left(mol\right)\end{matrix}\right.\)
⇒ 88x + 97y = 28,2 (1)
Ta có: \(n_{H_2S}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
BTNT S, có: x + y = 0,3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{0,1.88}{28,2}.100\%\approx31,2\text{% }\\\%m_{ZnS}\approx68,8\%\end{matrix}\right.\)
Bạn tham khảo nhé!

Đáp án C
Quy đổi hỗn hợp về Fe (x mol); Cu (y mol) và S (z mol)
Bảo toàn S có
nS = n↓ = 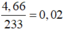 (mol)
(mol)
mX = 2,72 gam → 56x + 64y + 0,02.32 = 2,72 → 56x + 64y = 2,08 (1)
Do Y có thể hòa tan được Cu, bảo toàn electron có:
3.nFe + 2.nCu + 6.nS = 3.0,07 → 3x + 2y = 0,09 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,015.
Dung dịch Y gồm: Fe3+: 0,02 mol; Cu2+: 0,015 mol; SO42- = 0,02 mol; NO3- = (0,5 – 0,07 = 0,43 mol) và có thể có H+
Bảo toàn điện tích → nH+ = 0,38 mol
Cho Cu vào Y có phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
0,1425 ← 0,38 0,43 mol
Cu + 2Fe3+ → Cu2+ + 2Fe2+
0,01 ← 0,02 mol
m = (0,01 + 0,1425).64 = 9,76 gam.

Đáp án C.
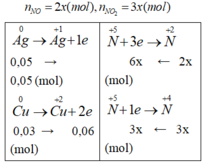
9x = 0,11; x= 11/900 => V = 5x.22,4 = 1,368 (l)

a/ Số mol Fe là 5,6:56=0,1 (mol).
Fe (0,1 mol) + 2HCl \(\rightarrow\) FeCl2 (0,1 mol) + H2 (0,1 mol).
Khối lượng muối và khí lần lượt là 0,1.127=12,7 (g) và 0,1.2=0,2 (g).
b/ Số mol Cu là 6,4:64=0,1 (mol).
Cu (0,1 mol) + 2H2SO4 đặc \(\underrightarrow{t^o}\) CuSO4 (0,1 mol) + SO2↑ (0,1 mol) + 2H2O.Khối lượng muối và khí lần lượt là 0,1.160=16 (g) và 0,1.64=6,4 (g).