Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$2NaHCO_3 + 2KOH \to Na_2CO_3 + K_2CO_3 + 2H_2O$
$n_{NaHCO_3} = n_{KOH} = 0,2.0,5 = 0,1(mol)$
$2NaOH + CO_2 \to Na_2CO_3 + H_2O$
$NaOH +C O_2 \to NaHCO_3$
$n_{NaOH} = 2n_{Na_2CO_3} + n_{NaHCO_3}$
$\Rightarrow n_{Na_2CO_3} = \dfrac{0,4 - 0,1}{2} = 0,15(mol)$
$\Rightarrow n_{CO_2} = 0,15 + 0,1 = 0,25(mol)$
$V = 0,25.22,4 = 5,6(lít)$

Đổi 400ml = 0,4l
\(n_{CO_2}=\frac{V_{CO_2}}{22,4}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
Ta có: \(C_{M_{KOH}}=\frac{n_{KOH}}{V_{KOH}}\Leftrightarrow n_{KOH}=C_{M_{KOH}}\cdot V_{KOH}=1\cdot0,4=0,4\left(mol\right)\)
Ta có tỉ lệ: \(T=\frac{n_{KOH}}{n_{CO_2}}=\frac{0,4}{0,25}=\frac{8}{5}=1,6\)
Vì 1 < T < 2 nên A chứa 2 muối (muối trung hoà + muối axit)
Ta có PT
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\left(1\right)\)
x 2x x x
\(CO_2+KOH\rightarrow KHCO_3\left(2\right)\)
y y y
Gọi x và y lần lượt là số mol của 2 muối K2CO3 và KHCO3
Theo phương trình (1) và (2) ta có hệ phương trình:
\(\left\{{}\begin{matrix}x+y=0,25\\2x+y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,1\end{matrix}\right.\)
Từ đó suy ra:
\(m_{K_2CO_3}=0,15\cdot138=20,7\left(g\right)\\ m_{KHCO_3}=0,1\cdot100=10\left(g\right)\)
P/s: Làm xong rùi hu hu TvT. Dài quá :v

\(n_{Ba\left(OH\right)_2}=0.2\cdot1.5=0.3\left(mol\right)\)
\(n_{KOH}=0.2\cdot1=0.2\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{47.28}{197}=0.24\left(mol\right)\)
TH1 : Không tạo ra Ba(HCO3)2
Ba(OH)2 + CO2 -> BaCO3 + H2O
nCO2 = nBaCO3 = 0.24 (mol)
VCO2 = 0.24 x 22.4 = 5.376 (l)
TH2 : Tạo ra Ba(HCO3)2
KOH + CO2 -> KHCO3
0.2.........0.2
Ba(OH)2 + CO2 -> BaCO3 + H2O
0.24............0.24.........0.24
Ba(OH)2 + 2CO2 -> Ba(HCO3)2
0.3 - 0.24......0.12
nCO2 = 0.2 + 0.24 + 0.12 = 0.56 (mol)
VCO2 = 0.56 x 22.4 = 12.544 (l)
\(\Rightarrow5.376\le V_{CO_2}\le12.544\)

nCO2=\(\dfrac{5.6}{22.4}\)=0.25 mol
nKOH=0.4 mol
Xét tỉ lệ 1< \(\dfrac{n_{KOH}}{n_{CO2}}=\dfrac{0.4}{0.25}=1.6\)<2
=> DD A gồm K2CO3 và KHCO3
2KOH+ CO2 -----> K2CO3+ H2O (1)
a.............0.5a..............0.5a......0.5a
KOH+ CO2 -------> KHCO3 (2)
b.............b....................b
Đặt a, b là số mol KOH ở (1), (2)
Theo đề bài ta có hệ pt\(\left\{{}\begin{matrix}n_{KOH}=a+b=0.4\\n_{CO2}=0.5a+b=0.25\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0.3\\b=0.1\end{matrix}\right.\)
=>mK2CO3=0.5a*138=20.7 g
=>mKHCO3=b*100=10 g

CO2+2NaOH\(\rightarrow\)Na2CO3+H2O
CO2+NaOH\(\rightarrow\)NaHCO3
Khi tác dụng với BaCl2 và Ba(OH)2 được kết tủa khác nhau chứng tỏ phải có phản ứng 2
Để có cả hai phản ứng thì 1<\(\frac{nNaOH}{nCO2}\)<2
\(\rightarrow\)1<b/a<2

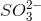 là 0,13 mol > tổng số mol
là 0,13 mol > tổng số mol 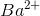 => m = 26,04
=> m = 26,04
\(n_{KOH}=0.2\cdot1=0.2\left(mol\right)\)
TH1 : Chỉ tạo ra muối K2CO3
\(n_{K_2CO_3}=\dfrac{19.9}{138}=0.144\left(mol\right)\)
\(n_{KOH}< 2n_{K_2CO_3}=0.288\)
=> Loại
TH2 : Tạo ra cả 2 muối
\(n_{K_2CO_3}=a\left(mol\right),n_{KHCO_3}=b\left(mol\right)\)
\(m_{Muối}=138a+100b=19.9\left(g\right)\)
Bảo toàn nguyên tố K :
\(2a+b=0.2\left(2\right)\)
\(\left(1\right),\left(2\right):a=\dfrac{1}{620},b=\dfrac{61}{310}\)
\(n_{SO_2}=\dfrac{1}{620}+\dfrac{61}{310}=\dfrac{123}{620}=0.2\left(mol\right)\)
\(n_{KOH}=0,2\left(mol\right)\)
Do hấp thụ hết SO2 nên không có SO2 dư, vậy ta có 2 trường hợp sau
TH1: KOH dư
\(n_{muối}=n_{K_2SO_3}=0,125\left(mol\right)\)
=> \(n_{KOH}=0,25>n_{KOH\left(bđ\right)}\) (loại)
TH2: Tạo 2 muối
Gọi x,y lần lượt là số mol KHSO3 và K2SO3
\(\left\{{}\begin{matrix}x+2y=0,2\\120x+158y=19,9\end{matrix}\right.\)
=>x=0,1, y=0,05
Bảo toàn nguyên tố S: \(n_{SO_2}=n_{KHSO_3}+n_{K_2SO_3}=0,15\left(mol\right)\)