Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!



12.
Na2CO3+H2SO4->Na2SO4+H2O+CO2
............. 0,5 ............. ......... 0,5
CO2+2KOH->K2CO3+H2O
x 2x x
CO2+KOH->KHCO3
y y y
mKOH=98.40/100=39,2g
nKOH=39,2/56=0,7mol
Có:
2x+y=0,7
138x+100y=57,6
=>x=0,2mol; y=0,3mol
mK2CO3=138.0,2=27,6g
mKHCO3=57,6-27,6=30g
b.
nCO2=x+y=0,2+0,3=0,5mol
CMddH2SO4=0,5/0,2=2,5M
8. Hoàn thành sơ đồ chuyển hóa sau:
Mg \(\underrightarrow{\left(1\right)}\) MgO \(\underrightarrow{\left(2\right)}\) MgCl2 \(\underrightarrow{\left(3\right)}\) Mg(OH)2 \(\underrightarrow{\left(4\right)}\) MgO \(\underrightarrow{\left(5\right)}\) MgSO4 \(\underrightarrow{\left(6\right)}\) MgCO3 \(\underrightarrow{\left(7\right)}\) MgO
\(\left(1\right)2Mg+O_2\underrightarrow{t^o}2MgO\)
\(\left(2\right)MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(3\right)MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(\left(4\right)Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(\left(5\right)MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(\left(6\right)MgSO_4+Na_2CO_3\rightarrow MgCO_3+Na_2SO_4\)
\(\left(7\right)MgCO_3\underrightarrow{t^o}MgO+CO_2\uparrow\)


A là dung dịch H2SO4
B: Na2CO3
C: H2SO4 đặc
D: Xút (NaOH)
Khi cho DD H2SO4 tác dụng với Na2CO3 giải phóng khí SO2 mang theo hơi nước.
Bình C để giữ hơi nước lại trong bình (H2SO4 đặc háu nước) SO2 không tác dụng tiếp tục được dẫn qua bình đựng.
Để tránh SO2 thoát ra bên ngoài gây ô nhiễm môi trường và 1 số bệnh cho con người nên Xút được đặt ở miệng bình để tạo muối.

 giúp em 2 câu này vs ạ ngày mai nộp rồi nhưng vẫn ko bt cách làm.Em cảm ơn trc ạ
giúp em 2 câu này vs ạ ngày mai nộp rồi nhưng vẫn ko bt cách làm.Em cảm ơn trc ạ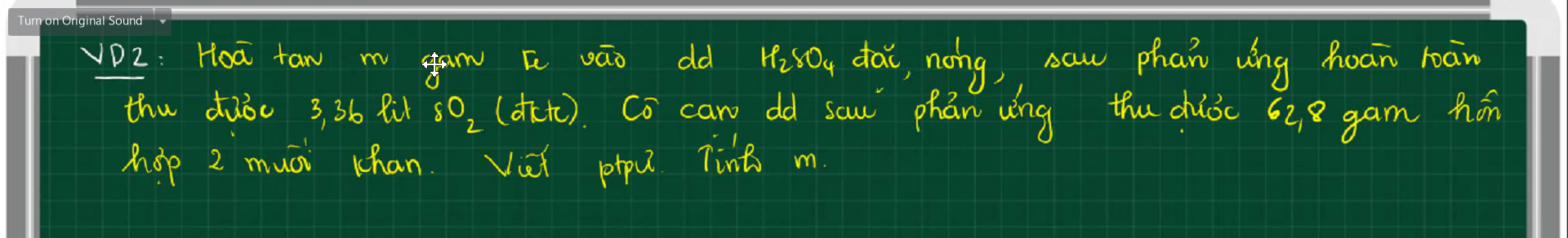











Câu 10:
\(n_{Na_2O}=\dfrac{6,2}{62}=0,1\left(mol\right)\\ Na_2O+H_2O\rightarrow2NaOH\\ n_{NaOH}=0,1.2=0,2\left(mol\right)\\ a,C_{M\text{dd}NaOH}=\dfrac{0,2}{0,4}=0,5\left(M\right)\\ b,2NaOH+MgCl_2\rightarrow Mg\left(OH\right)_2+2NaCl\\ n_{MgCl_2}=2.0,2=0,4\left(mol\right)\\ V\text{ì}:\dfrac{0,2}{2}< \dfrac{0,4}{1}\Rightarrow MgCl_2d\text{ư}\\ n_{Mg\left(OH\right)_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ m_{Mg\left(OH\right)_2}=m_{\downarrow}=0,1.58=5,8\left(g\right)\)
Câu 7:
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{Ca\left(OH\right)_2}=0,25.2=0,5\left(mol\right)\\ V\text{ì}:1>\dfrac{n_{CO_2}}{n_{Ca\left(OH\right)_2}}=\dfrac{0,3}{0,5}=0,6\Rightarrow Ca\left(OH\right)_2d\text{ư}\\ Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3\downarrow+H_2O\\ n_{CaCO_3}=n_{CO_2}=0,3\left(mol\right)\\ m_{CaCO_3}=100.0,3=30\left(g\right)\)