
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Câu 5
2Al+3H2SO4->Al2(SO4)3+3H2
0,2------------------0,1----------0,3 mol
`n_(H_2)=(6,72)/(22,4)=0,3 mol`
`=>m_(Al_2(SO_4)_3)=0,1.342=34,2g`
c)`3H_2+Fe_2O_3->2Fe+3H_2O`to
0,3----------------------0,2 mol
H=95%
`=>m_(Fe)=0,2.56.95%=10,64g`
`#YBTran:3`

n Fe=0,5 mol
Fe+H2sO4->FeSO4+H2
0,5----------------------------0,5
=>VH2=0,5.22,4=11,2l
b) 2H2+O2-to>2H2O
0,5-------------------0,5
=>m H2O=0,5.18=9g
a. \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
PTHH : Fe + H2SO4 ( loãng ) -> FeSO4 + H2
0,5 0,5
\(V_{H_2}=0,5.22,4=11,2\left(l\right)\)
b. PTHH : 2H2 + O2 -> 2H2O
0,5 0,5
\(m_{H_2O}=0,5.18=9\left(g\right)\)


1 oxit kim loại hóa trị 3 là al2o3
dẫn khối lượng 16g h2
pthh 2al2o3 + 6h2-> 4al + 6h2o ( điều kiện phản ứng là nhiệt độ )
d.\(n_{H_2}=0,3mol\) ( đã tính ở câu b )
Gọi kim loại hóa trị III đó là R
\(R_2O_3+3H_2\rightarrow\left(t^o\right)2R+3H_2O\)
0,1 0,3 ( mol )
Ta có:\(n_{R_2O_3}=\dfrac{16}{2M_R+48}\left(mol\right)\)
\(\rightarrow n_{R_2O_3}=\dfrac{16}{2M_R+48}=0,1\)
\(\rightarrow M_R=56\) ( g/mol )
--> R là Sắt (Fe)

 Giúp mình giải các câu hỏi trên trừ 2 câu khoanh tròn vì mình đã làm r giúp mik với :3 cảm ơn nhiều ( lưu ý : giải chi tiết vì mình đang bắt đầu học )
Giúp mình giải các câu hỏi trên trừ 2 câu khoanh tròn vì mình đã làm r giúp mik với :3 cảm ơn nhiều ( lưu ý : giải chi tiết vì mình đang bắt đầu học )
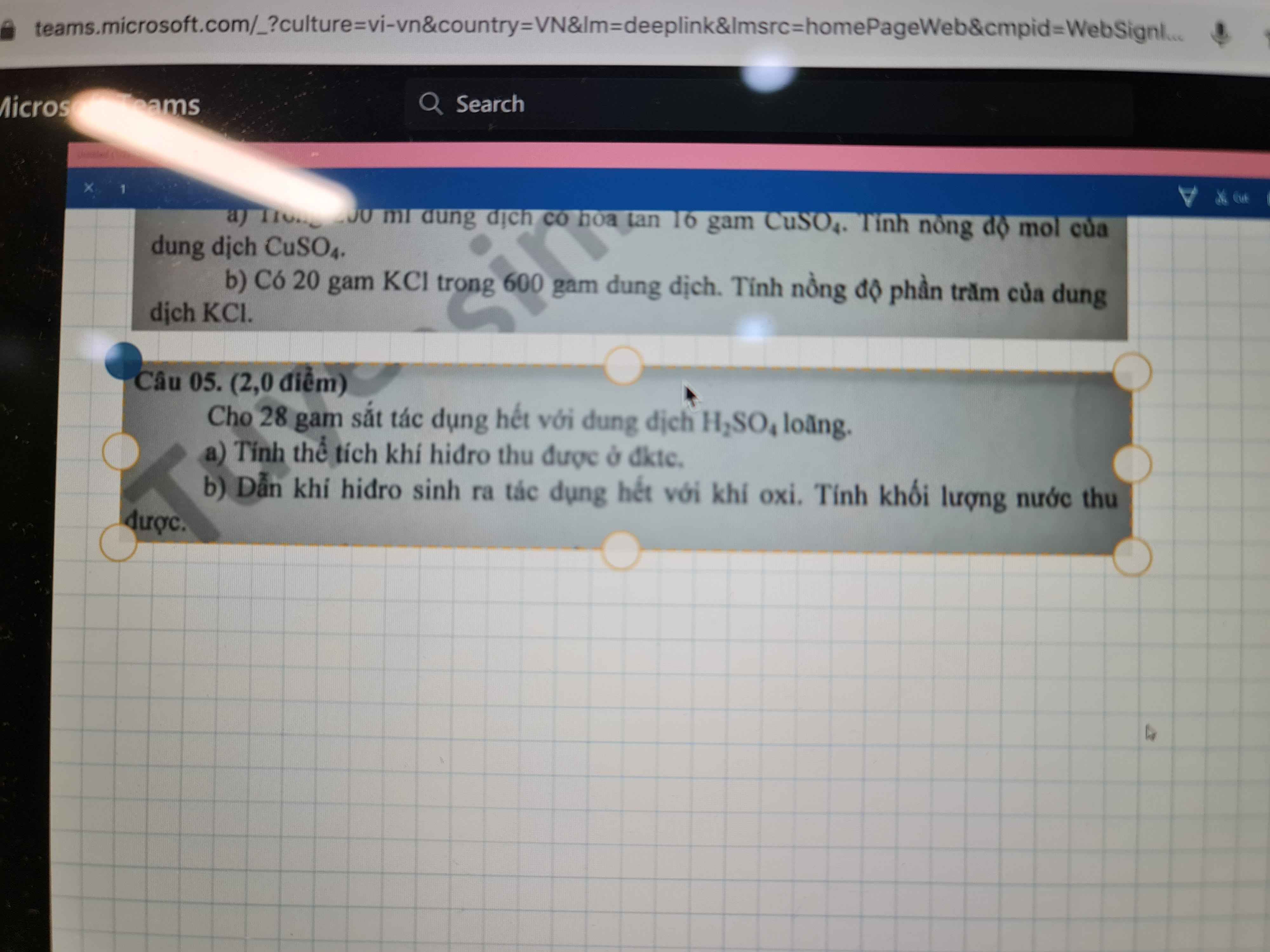
 giải giúp mình câu 5 với ạ
giải giúp mình câu 5 với ạ 




a) Zn + 2HCl $\to$ ZnCl2 + H2
b)
n H2 = n Zn = 9,75/65 = 0,15(mol)
V H2 = 0,15.22,4 = 3,36(lít)
n HCl = 2n H2 = 0,3 mol
=> m HCl = 0,3.36,5 = 10,95 gam
c) n CuO = 24/80 = 0,3(mol)
CuO + H2 $\xrightarrow{t^o}$ Cu + H2O
n CuO = 0,3 > n H2 = 0,15 => CuO dư
n Cu = n H2 = 0,15 mol
=> m Cu = 0,15.64 = 9,6 gam
Câu 3 :
\(n_{Zn}=\dfrac{9.75}{65}=0.15\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.15.......0.3..................0.15\)
\(V_{H_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(m_{HCl}=0.3\cdot36.5=10.95\left(g\right)\)
\(n_{CuO}=\dfrac{24}{80}=0.3\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1..........1\)
\(0.3........0.15\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.15}{1}\Rightarrow CuOdư\)
\(n_{Cu}=n_{H_2}=0.15\left(mol\right)\)
\(m_{Cu}=0.15\cdot64=9.6\left(g\right)\)