Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Trong mỗi phần chứa nCu(NO3)2 = a và nHCl = b
Cu(NO3)2 +2HCl → Cu + Cl2 + 2HNO3
0,14 ←0,28 ←0,14 →0,28
Dung dịch sau điện phân chứa Cu(NO3)2 dư ( a – 0,14) ; HCl dư (b – 0,28) và HNO3 ( 0,28)
nNaOH = 2 ( a – 0,14 ) + ( b – 0,28) + 0,28 = 0,44 (1)
nCu(OH)2 ↓= a – 0,14 = 0,02 (mol) (2)
Từ (1) và (2) => a = 0,16 và b = 0,4
Phần 2:
nHCl = 0,4 mol => nNO = 0,1 => VNO = 2,24 (lít)
Bảo toàn electron:
2nFe pư = 2nCu2+ + 3nNO => nFe pư = 0,31 (mol)
=> m – 0,31.56 + 0,16.64 = 0,7m
=> m = 23,73 (g)
Vậy m = 23,73 g và V = 2,24 lít

Chọn D.
Ta có: ![]()
![]()
Khối lượng dung dịch giảm: ![]()
![]()
Giải hệ ta được: ![]()
Dung dịch sau điện phân gồm NaNO3 (0,08 mol) và HNO3 (0,06.4 – 0,02.2 = 0,2 mol),
Khi cho Fe tác dụng với dung dịch trên thì thu được dung dịch chứa Fe(NO3)2 và NaNO3.
với ![]()
![]()

Đáp án C
n N a C l = 0 , 18 m o l
Điện phân dung dịch X sau một thơi gian thấy giảm 18,65 gam
Cho Fe vào dung dịch thu được 0,035 mol NO do vậy dung dịch có H+. Do đó Cl- bị điện phân hết trước Cu2+.
Ta có: 3 F e + 8 H + + 2 N O 3 - → 3 F e 2 + + 2 N O + 4 H 2 O
(do Fe dư).
Lượng Fe bị ăn mòn do phản ứng này là chính bằng khối lượng thanh Fe giảm.
Do vậy Cu2+ bị điện phân hết
Ta có: n H + = 0 , 035 . 4 = 0 , 14 m o l → n C u + = 0 , 18 + 0 , 14 2 = 0 , 16 m o l
Vậy: m H 2 O đ p = 18 , 65 - 0 , 16 . 64 - 0 , 09 . 71 - 0 , 035 . 32 = 0 , 9 g a m
→ n H 2 O = 0 , 05 m o l → n e = 0 , 18 + 0 , 14 + 0 , 05 . 2 = 0 , 42 m o l → t = 8106

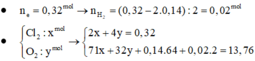
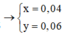
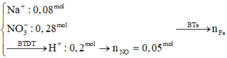
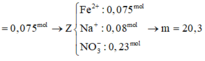




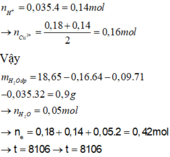
Đáp án A