Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CaSO4 : làm vật liệu xây dựng, phụ gia món ăn
BaSO4: bột màu phụ gia công nghiệp sơn
MgSO4: sản xuất muối tắm

BTNT H, có: nH2SO4 = nH2 = a (mol)
BTKL, có: mKL + mH2SO4 = m muối + mH2
⇒ 10,5 + 98a = 30 + 2a
⇒ a = 0,203125 (mol)

Ammonium sulfate ((NH4)2SO4) ở dạng tinh thể màu trắng, chủ yếu được dùng làm phân bón cung cấp đạm cho đất.
Magnesium sulfate (MgSO4) ở dạng tinh thể màu trắng, chủ yếu được sử dụng làm phân bón. Muối này còn được sử dụng làm thuốc để cung cấp magnesium cho cơ thể, giúp giảm các cơn đau cơ, giảm hiện tượng chuột rút. Mỗi phân tử magnesium sulfate có thể kết hợp với 7 phân tử nước để tạo MgSO4.7H2O. Vì vậy, magnesium sulfate còn được sử dụng làm chất hút ẩm, chất hút mồ hôi tay của các vận động viên thể dục dụng cụ.
Barium sulfate (BaSO4) ở dạng tinh thể màu trắng, được sử dụng rộng rãi trong các lĩnh vực như sơn, mực in, nhựa, lớp phủ, men, thuỷ tinh, khai thác khoáng sản, sản xuất các loại giấy trắng chất lượng cao. Trong y tế, barium sulfate là thành phần chính của thuốc cản quang trong kĩ thuật X-quang.

Ta nhỏ dung dịch BaCl2 vào . Nếu thấy tạo kết tủa trắng thì đó là dung dịch (NH4)2SO4
Pt : \(BaCl_2+\left(NH_4\right)_2SO_4\rightarrow2NH_4Cl+BaSO_4\downarrow\)
- Dán nhãn

Cả hai phản ứng trên, số oxi hóa của nito đều không đổi ( đều là phản ứng oxit hóa nội phân tử)
Trong hai phản ứng :
$NH_4^+$ đều là chất khử ( số hóa oxi hóa của N tăng từ -3 lên 0)
$NO_3^- , NO_3^-$ đều là chất oxi hóa ( số oxi hóa của N lần lượt giảm từ +3 xuống 0 và giảm từ +5 xuống +1)

Phản ứng nhiệt phân:
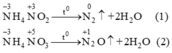
Trong hai phản ứng trên số oxi hoá của nitơ trong mỗi phản ứng đều thay đổi. Trong mỗi phân tử muối một nguyên tử nitơ có số oxi hoá tăng, một nguyên tử có số oxi hoá giảm, đây là phản ứng oxi hoá khử nội phân tử.Ở cả hai phản ứng nitơ nguyên tử trong ion NH+4 đều là chất khử (chất cho e) nitơ từ số oxi hoá -3 tăng lên 0 ở phản ứng (1) và lên +1 ở phản ứng (2).Nguyên tử nitơ trong ion NO2- và NO3- là chất oxi hoá (chất nhận e). Ở phản ứng (1) số oxi hoá của N từ +3 (trong NO2- ) xuống 0 và ở phản ứng (2) số oxi hoá của nitơ từ +5 (trong NO3-) xuống +1.

Tham khảo:
Hiện tượng: dung dịch CuSO4 phản ứng với dung dịch NaOH dung dịch tạo kết tủa Cu(OH)2 màu xanh.
- Ống nghiệm 1: nhỏ dung dịch ethanol vào không có hiện tượng xảy ra.
- Ống nghiệm 2: nhỏ dung dịch glixerol vào thấy tạo phức màu xanh thẫm.
- PTHH: 2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O

Ở 20 oC, độ tan của barium sulfate là 0,2448 mg/100 g H2O, độ tan của magnesium sulfate là 33,7 g/100 g H2O.
Như vậy để phân biệt muối magnesium sulfate và muối barium sulfate, ta dựa vào độ tan của hai muối trên.
Lấy cùng một lượng muối magnesium sulfate và muối barium sulfate, hòa tan mỗi muối trên vào trong 2 cốc chứa cùng một lượng nước, ở cùng một nhiệt độ và khuấy đều. Muối tan tốt hơn là magnesium sulfate, muối hầu như không tan là barium sulfate.