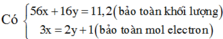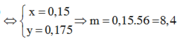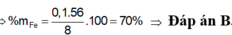Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là
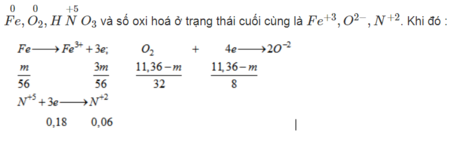
Áp dụng ĐLBT electron ta có:
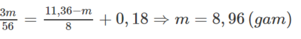

a) Gọi số mol của Al và Fe trong 13,8 gam hỗn hợp lần lượt là x và y
nH2 = 10,08:22.4= 0,45 mol
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
x ------------------------------------------>3/2x
Fe + H2SO4 → FeSO4 + H2
y ------------------------------------> y
Ta có hệ pt\(\left\{{}\begin{matrix}27x+56y=13,8\\\dfrac{3}{2}x+y=0,45\end{matrix}\right.\) => x = 0,2 và y = 0,15
=> mFe = 0,15.56 = 8,4 gam <=> %mFe = \(\dfrac{8,4}{13,8}\).100% = 60,87%
b)
X + O2 → Y
Bảo toàn khối lượng => mO2 = mY - mX = 5,76 gam <=> nO2 = 0,18 mol
Ta có sơ đồ: \(\left\{{}\begin{matrix}Fe\\Al\end{matrix}\right.\) + O2 → Y \(\underrightarrow{H_2SO_4đ,n}\) → Fe2(SO4)3 + Al2(SO4)3 + SO2 + H2O
Các quá trình oxi hóa - khử:
Fe0 → Fe+3 + 3e O20 + 4e → 2O-2
0,15 -> 0,45 0,18 --> 0,72
Al0 → Al+3 + 3e S+6 + 2e → S+4
0,2 -> 0,6 2x <- x
Áp dụng ĐLBT electron => 2x + 0,72 = 0,45 + 0,6
<=> x = 0,165
=>V SO2 đktc = 0,165.22,4 = 3,696 lít