Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn Na: mol NaOH=2*mol Na2CO3 = 0.06
Bảo toàn khối lượng ==> mH2O = 2,76 + 40*0,06 - 4,44 = 0,72 ==> mol H2O = 0,04
CxHyOz + NaOH ---> muối CxHy-1O2Na + H2O (1)
----a--------0,06----------------------------------0,04
muối CxHy-1O2Na + O2 ----> CO2 + H2O + Na2CO3 (2)
------------------------------------0,11---0,05-----0,03
(1)+(2): CxHyO2Na + NaOH + O2 ----> CO2 + H2O + Na2CO3 (2)
-----------------a------------------------------0,11---0,09-----0,03
mol H: ay + 0,06 = 2*0.09 = 0,18 ===> ay = 0,12
Khi A cháy ==> mol H2O = 0,5ay = 0,06 ==> m H2O = 1,08
Theo bài ra, thu được 4,44g 2 muối + nước
\(\Rightarrow\) 2 x 76 + 0,06 x 40 = 4,44 + m(g) nước
A = CxHyO2
nC = 0,14mol; nH = 0,1 + 0,04 − 0,06 = 0,08
nO = \(\frac{2\times76-m_C-m_H}{16}\) = 0,06
\(\Rightarrow\) Công thức phân tử: C7H6O3.
Đốt cháy thu \(n_{H_2O}\) = 0,02 x 3 = 0,06 mol \(\Rightarrow\) \(m_{H_2O}\) = 0,06 x 18 = 1,08 gam.

Quy đổi hỗn hợp thành RCOOH
nRCOOH= 2nH2=0,5 mol => nOtrong axit=2nRCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 mol
CO2 + Ba(OH)2---> BaCO3+ H2O
nBa(OH)2=0,7 mol < nCO2 => Ba(OH)2 hết và CO2 dư
=> m Kết tủa = 0,7*(MBaCO3)=137,9 gam.
nCOOH= nNaHCO3=nCO2=0,5 mol => nOtrong axit=2nCOOH=1 mol
m axit=mC+mH+mO=> mC=29,6-2.14,4/18-1.16=12 g => nCO2=nC=1 => mCO2=44

Dùng số đếm, gạch đi một chất, ví dụ gạch glixerrol là được.
đáp án B

Câu 30: Hỗn hợp M gồm hai axit cacboxylic X và Y (hơn kém nhau một nguyên tử cacbon trong phân tử). Đốt cháy hoàn toàn 0,2 mol M cần vừa đủ V lít O2 (đktc), thu được 0,45 mol CO2 và 0,2 mol H2O. Giá trị của V là
D. 4,48
Note: Nếu bạn muốn hiểu chi tiết lời giải, bạn có thể tham khảo tại đây nha:
Thư viện Đề thi & Kiểm tra

Có 0,1 mol chất béo \(\Rightarrow\) tạo ra 0,1 mol glixerol.
\(\Rightarrow\) m = 0,1 x 92 = 9,2 gam.

Quy đổi: CnH4 => 12n+4 = 34 => n trung bình là 2,5
Áp dụng bảo toàn nguyên tố:nCO2 = 2,5 . 0,05 = 0,125 mol
nH2O = 0,2 mol
=> m = 0,125.44 + 0,1.18 = 7,3 g.
mol H2O phải =0,1mol vì bảo toàn ng tố H+ theo mol CnH4 .Việt viết nhầm thôi chứ thay vào đ/a đúng mà,,

MA = 44,5 . 2 = 89 (g/mol)
Ta có: mC = = 3,6 (gam); mH =
= 0,7 (gam)
mN = = 1,4 (gam); mO = 8,9 – (3,6 + 0,7 + 1,4) = 3,2 (gam)
Gọi CTPT của A là CxHyOzNt,
x : y : z : t = = 0,3 : 0,7 : 0,2 : 0,1 = 3 : 7 : 2 : 1
=> CTPT của A là (C3H7O2N)n ; MA = 89 g/mol => n = 1
Vậy CTPT của A là C3H7O2N
CTCT: 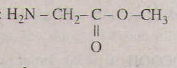
![]()
MA= 44,5.2=89
=> nX= 8,9/89=0,1 mol
Đặt CTTQ của X là CxHyNzO1 ( 0,1 mol)
CxHyNzO1 + (x+y/4 - z/2)O2----> xCO2 + y/2H2O + t/2N2
0,1----> 0,1.(x+y/4 - z/2)-----> 0,1x----->0,05y---->0,05t
Ta có:
0,1x=13,2/44
0,05y=6,3/18
0,05t=1,12/22,4
12x+y+16z+14t=89
HỎI:
Tại sao lại ra kết quả này: 12x+y+16z+14t
Lấy 12 và y và 16 và 14 ở đâu ra vậy?
Hay:
có phải nó là cái bắt buộc, bài nào nào tưong tự như vậy cũng phải có:12x+y+16z+14t

Đáp án: D