Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Nhận thấy b-c= 4a → trong X có 5 liên kết π trong đó có 3 liên kết π ở gốc COO và 2 liên kết π ở gốc hidrocacbon C=C
Như vậy để hidro hóa hoàn toàn 1 mol X cần dùng 2 mol H2 → nX = 0,18 : 2 = 0,09 mol
Bảo toàn khối lương → mX = 77,58 - 0,18. 2= 77,22 gam
Khi tham gia phản ứng thủy phân → nC3H5(OH)3 = nX = 0,09 mol
Bảo toàn khối lượng → mchất rắn = mX + mKOH - mC3H5(OH)3
→ mchât rắn = 77,22 + 0,3. 56 - 0,09. 92 = 85,74 gam.

Chọn đáp án C
Nhận thấy b-c= 4a ⇒ trong X có 5 liên kết π trong đó có 3 liên kết π ở gốc –COO– và 2 liên kết π ở gốc hidrocacbon C=C.
Như vậy để hidro hóa hoàn toàn 1 mol X cần dùng 2 mol H2 ⇒ nX = 0,3 : 2 = 0,15 mol
Bảo toàn khối lương → mX = 39 - 0,3. 2= 38,4 gam
Khi tham gia phản ứng thủy phân ⇒ nC3H5(OH)3 = nX = 0,15 mol
Bảo toàn khối lượng → mChất rắn = mX + mNaOH - mC3H5(OH)3
⇒ mChất rắn = 38,4 + 0,7x40 – 0,15x92 = 52,6 gam

Đáp án C
Nhận thấy b-c= 4a ⇒ trong X có 5 liên kết π trong đó có 3 liên kết π ở gốc –COO– và 2 liên kết π ở gốc hidrocacbon C=C.
Như vậy để hidro hóa hoàn toàn 1 mol X cần dùng 2 mol H2 ⇒ = 0,3 : 2 = 0,15 mol
Bảo toàn khối lương → m x = 39 - 0,3. 2= 38,4 gam
Khi tham gia phản ứng thủy phân ⇒
![]()
Bảo toàn khối lượng → mChất rắn =
![]()
⇒ mChất rắn = 38,4 + 0,7x40 – 0,15x92 = 52,6 gam

Đáp án D
► Đối với HCHC chứa C, H và có thể có O thì:
nCO2 – nH2O = (k – 1).nHCHC (với k là độ bất bão hòa của HCHC).
► Áp dụng: b – c = 4a ⇒ k = 5 = 3πC=O + 2πC=C.
⇒ nX = nH2 ÷ 2 = 0,15 mol || Bảo toàn khối lượng:
m1 = 39 – 0,3 × 2 = 38,4(g). Lại có: nNaOH ÷ nX > 3.
⇒ NaOH dư ⇒ nglixerol = nX = 0,15 mol. Bảo toàn khối lượng:
||⇒ m2 = 38,4 + 0,7 × 40 – 0,15 × 92 = 52,6(g)

nH2 = 6,72/22,4 = 0,3 mol
Đốt với hợp chất hữu cơ chứa C, H và O ( nếu có) thì khi đốt cháy ta có:
nCO2 - nH2O = (k-1).nHCHC
→ k = 5 = 3pC = O + 2pC = C
Mặt khác: 1pC = C + 1H2 → nX = 1/2 nH2 = 0,15mol
Bảo toàn khối lượng: m1 = 39 – mH2= 39 - 0,3.2 = 38,4 g
Dễ thấy NaOH dư → nglixerol = nX = 0,15 mol
→ m2 = m1 + mNaOH – mglixerol = 38,4 + 0,7.40 – 0,15.92 = 52,6 g
→ Đáp án D

Giải thích:
Đốt cháy hợp chất hữu cơ X CnH2n+2-2k có độ bất bão hòa k ta luôn thu được
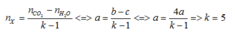
=> Công thức trieste của glixerol với các axit đơn chức, mạch hở là: CnH2n-8 O6
(X có 5 liên kết pi trong đó có 2 liên kết pi của gốc axit)
nH2 = 0,3 (mol)
CnH2n-8 O6 + 2H2 → CnH2n-4 O6
0,15 ← 0,3
BTKL => m1 = 39- mH2 = 39 – 0,3.2 = 38, 4 (g)
X + 3NaOH→ hỗn hợp muối + C3H5(OH)3
0,15→ 0,45 →0,15
BTKL ta có: m2 = mX + mNaOH – mC3H5(OH)3 = 38,4 + 0,7.40 – 0,15.92 = 52, 6 (gam)
Đáp án D
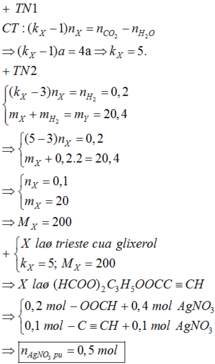

CTTQ của este là CnH2n+2-2k-2zO2z với k là số liên kết pi giữa C và C, z là số nhóm chức este.
=> CTTQ của X là: CnH2n-2k-4O6
CnH2n-2k-4O6 + O2 → nCO2 + (n - k -2)H2O
Theo đề bài ta có: n - (n - k -2) = 4
<=> k = 2
Vậy X sẽ phản ứng với H2 theo tỉ lệ 1 : 2
=> nX = 1/2nH2 = 0,1 mol = nY
BTKL => mX = mY - mH2 = 20gam
=> MX = 20:0,1 = 200
X có dạng (\(\overline{R}\)COO)3C3H5
=> \(\overline{R}\) = 27
Vì X có phản ứng tráng gương và 2 liên kết pi C với C => X tạo bởi 2 axit đơn chức là HCOOH và 1 axit đơn chức CH\(\equiv\)C-COOH
=> X sẽ phản ứng được với 4AgNO3 /NH3
<=> x = 4a = 0,4