Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
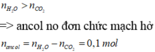
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
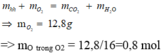
Áp dụng định luật bảo toàn nguyên tố oxi:
nO trong ancol + nO trong axit + nO trong O2
= nO trong CO2 + nO trong H2O
=> nO trong axit = 2.0,3 + 0,4 - 0,1 - 0,8 = 0,1 mol
=> naxit= 0,05 mol
Gọi m, n lần lượt là số ntử C của ancol, axit m ≠ n
=> 0,1m + 0,05n = 0,3
=> m =1, n=4
=> CTPT: CH3OH, C3H7COOH
=> CT este C3H7COOCH3
=> phản ứng este hóa, ancol dư 0,05 mol, axit hết
=> meste lí thuyết = 005.102 = 5,1 g
=> meste thực tế = 5,1.80% = 4,08g

(mol) ;
(mol).
(mol) => m = 0,02.304 = 6,08 (gam).
X là C17H31COOC3H5(C17H33COO)2 ; nX = nglixerol = 0,01 mol
=> a = 0,01.882 = 8,82 (gam)

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có:  = 0,2
= 0,2
=> a = 29,89.

VO2(pư)=1/5Vkk=8.4(l).theo bài ra ta có nCO2+N2=44.8/22.4=2(1)lại có dB/H2=15=>nCO2/nN2=1/7(2).từ (1)và(2)=>nCO2=0.25(mol)và nN2=1.75(mol).
áp dụng ĐLBTKL ta có m=mCO2+mH2O+mN2-mO2(pư)=57(gam).ta lại có mC+mH+mN=nCO2.12+2.nH2O+28.nN2=53(gam) <57(gam)=>trong A có nguyên tố oxi mO=57-53=4(gam).gọi CTĐGN của A là CxHyOzNt ta có:x:y:z:t=nCO2:2nH2O:nO:2nN2=1:4:1:14=>CTĐGN của A:CH4ON14.lại có 12n+4n+16n+196n=600(tớ nghĩ phải là 600 chứ A chứa nhiều nguyên tố lắm)=>n=3=>CTHH của A:C3H12O3N42.

Bài giải:
- Vì =
=>
=
, suy ra polime đó là polietilen (-CH2 – CH2 - )n.
- Không thể là tinh bột (-C6H10O5-)n, vì có tỉ lệ =
, cũng không thể là PVC vì chất này khi cháy phải có sinh ra hợp chất chứa clo.

\(n_{Fe\left(NO_3\right)_3}=0,14mol\)
Đặt \(n_{Fe}=n_{FeO}=n_{Fe_2O_3}=n_{Fe_3O_4}=x\)
\(Fe\rightarrow Fe^{3+}\)
x x
\(FeO\rightarrow Fe^{3+}\)
x x
\(Fe_2O_3\rightarrow2Fe^{3+}\)
x 2x
\(Fe_3O_4\rightarrow3Fe^{3+}\)
x 3x
\(\Rightarrow7x=0,14\Rightarrow x=0,02\Rightarrow m=10,4g\)
Chọn đáp án D
7,6(g) X + ?O2 → 0,3 mol CO2 + 0,4 mol H2O. Bảo toàn khối lượng:
||⇒ mO2 = 0,3 × 44 + 0,4 × 18 - 7,6 = 12,8(g) ⇒ nO2 = 0,4 mol. Bảo toàn nguyên tố Oxi:
nO/X = 0,3 × 2 + 0,4 – 0,4 × 2 = 0,2 mol. Do nCO2 < nH2O ⇒ ancol no, đơn chức, mạch hở.
Ta có: nCO2 – nH2O = (k – 1).nHCHC (với k là độ bất bão hòa của HCHC).
► Áp dụng: nancol = ∑nH2O - ∑nCO2 = 0,1 mol ⇒ naxit = (0,2 - 0,1) ÷ 2 = 0,05 mol.
Đặt số C của axit và ancol là a và b ⇒ 0,1a + 0,05b = 0,3 → a ≠ b a , b ≥ 1 a = 1 và b = 4
⇒ X gồm HCOOH và C4H9OH. Do naxit < nancol ⇒ hiệu suất tính theo axit.
► Este là HCOOC4H9 với số mol 0,04 ⇒ m = 0,04 × 102 = 4,08(g) ⇒ chọn D