Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{NO}=n_{NO_2}=0,0175(mol)$
Quy hỗn hợp A về Fe và O với số mol lần lượt là a;b(mol)
Ta có: $56a+16b=5,04(g);3a-2b=0,07(mol)$
Suy ra $a=b=0,07$
Vậy x=0,07
Coi A gồm Fe(x mol) ; O(y mol)
Suy ra: 56x + 16y = 5,04(1)
Gọi : \(\left\{{}\begin{matrix}n_{NO}=a\left(mol\right)\\n_{NO_2}=b\left(mol\right)\end{matrix}\right.\)
Suy ra: \(\left\{{}\begin{matrix}a+b=0,035\\30a+46b=0,035.2.19\end{matrix}\right.\)
Suy ra: a = 0,0175 ; b = 0,0175
\(Fe^0 \to Fe^{+3} + 3e\\ 2e+O^0 \to O^{-2} \\ 3e + N^{+5} \to N^+{+2}\\ 1e + N^{+5} \to N^{+4}\)
Bảo toàn e :
3x = 2y + 0,0175.3 + 0,0175.1(2)
(1)(2) suy ra: x = 0,07 ; y = 0,07
Vậy x = 0,07

\(n_{Br_2}=0,3.2,5=0,75\left(mol\right)\)
PTHH: SO2 + 2H2O + Br2 ---> H2SO4 + 2HBr
0,75<------------0,75
MA = 1,6.28 = 44,8 (g/mol)
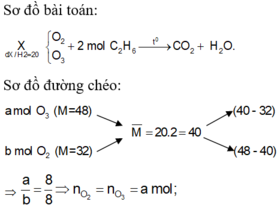
O2 dư tác dụng với S thì sau phản ứng chứa O2 và SO2
Áp dụng sơ đồ đường chéo đối với A:
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{V_{SO_2}}{V_{O_2}}=\dfrac{44,8-32}{64-44,8}=\dfrac{2}{3}\)
\(\rightarrow n_{O_2}=\dfrac{3}{2}.0,75=1,125\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,75<-0,75<-----0,75
=> \(\left\{{}\begin{matrix}m=0,75.32=24\left(g\right)\\V=\left(1,125+0,75\right).22,4=42\left(l\right)\end{matrix}\right.\)

PTHH của các phản ứng :
2CO + O 2 → 2C O 2 (1)
3CO + O 3 → 3C O 2 (2)
Trong 1 mol hỗn hợp khí A có 0,6 mol O 3 và 0,4 mol O 2
Theo (1): 0,6 mol O 2 đốt cháy được 1,2 mol CO.
Theo (2) : 0,4 mol O 3 đốt cháy được 1,2 mol CO.
Kết luận : 1 mol hỗn hợp khí A đốt cháy được 2,4 mol khí CO.

\(H_2+Cl_2\rightarrow2HCl\)
X chắc chắn có : HCl
\(\overline{M}=9.625\cdot2=19.25\left(\dfrac{g}{mol}\right)\)
=> X chứa : H2 dư
\(Giảsử:n_A=1\left(mol\right)\)
\(n_{Cl_2}=a\left(mol\right)\Rightarrow n_{H_2}=1-a\left(mol\right)\)
\(\overline{M}=\dfrac{36.5\cdot2a+\left(1-2a\right)\cdot2}{1-2a+2a}=19.25\)
\(\Rightarrow a=0.25\)
\(\%H_2=\dfrac{1-0.25}{1}\cdot100\%=75\%\)
Chúc học tốt <3
Ôi cảm ơn b nhiều lắm, b có thể giúp mình thêm 1 câu nữa đc k?

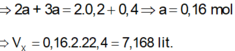
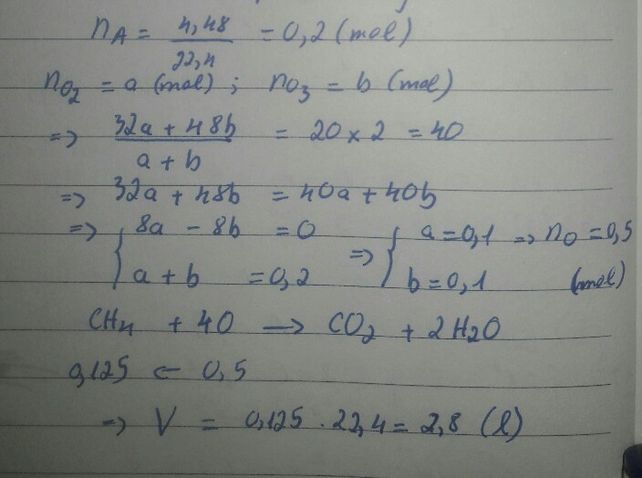

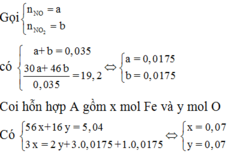
\(n_C=0.3\left(mol\right)\)
\(n_{O_2}=0.35\left(mol\right)\)
\(C+O_2\underrightarrow{^{t^0}}CO_2\)
\(0.3...0.3....0.3\)
\(n_{O_2\left(dư\right)}=0.35-0.3=0.05\left(mol\right)\)
\(\overline{M}=\dfrac{0.05\cdot32+0.3\cdot44}{0.05+0.3}=\dfrac{296}{7}\left(\dfrac{g}{mol}\right)\)
\(d_{\dfrac{X}{H_2}}=\dfrac{\dfrac{296}{7}}{2}=21.1\)
Phản ứng đầu tiên:
C + O2 \(\xrightarrow[]{t^o}\) CO2
nC = \(\dfrac{3,6}{12}=0,3mol\)
nO2 = \(\dfrac{7,84}{22,4}=0,35mol\)
Lập tỉ lệ nC : nO2 = \(\dfrac{0,3}{1}:\dfrac{0,35}{1}=0,3:0,35\)
=> O2 dư
Sau phản ứng thu được Oxi và CO2
\(d\dfrac{k}{H_2}=\dfrac{32+44}{2}=38\)