Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)

CxH2x +2 + (3x+1)/2O2 → t ∘ x CO2 + (x+1) H2O
CyH2y + 3y/2O2 → t ∘ y CO2 + y H2O
CzH2z-2 + (3z-1)/2O2 → t ∘ zCO2 + (z-1) H2O
Khi đốt cháy hỗn hợp A thu được CO2 và H2O. Cho sản phẩm qua Ca(OH)2 dư thì khối lượng bình tăng chính là khối lượng của H2O và CO2
=> mCO2 + mH2O = 9,56 (g)
CO2 + Ca(OH)2 → CaCO3↓ + H2O
nCO2 = nCaCO3 = 16/100 = 0,16 (mol)
=> nH2O = (9,56 – 0,16.44)/18 = 0,14 (mol)
Ta có hệ phương trình:
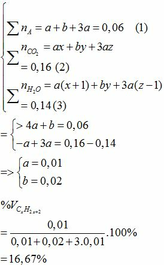
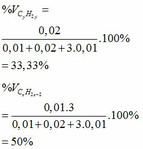
b)
thế a, b vào (2) => 0,01x + 0,02y + 3.0,01z = 0,16
=> x + y +3z = 16
Vì có 2 hidrocacbon bằng nhau và bằng một nửa số cacbon của hidrocacbon còn lại nên có các trường hợp sau:
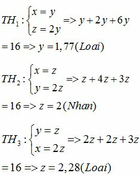
Vậy công thức phân tử của 3 hidrocacbon là: C2H6; C2H4 và C2H2

1. X là CH2Cl2.
2. CnH2n+2 + (3n+1)/2 O2 ---> nCO2 + (n+1) H2O
Theo bài ra, tỷ lệ số mol ankan : số mol oxi pư = 30: (180 - 30) = 1:5
=> 3n+1/2 = 5 => n = 3
vậy ankan là C3H8 : CH3 - CH2 - CH3 : Propan

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{17,92}{22,4}=0,8\left(mol\right)\left(1\right)\)
\(n_{H_2O}=2n_{CH_4}+2n_{C_2H_4}=2x+2y=\dfrac{10,8}{18}=0,6\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
%V cũng là %n ở cùng điều kiện nhiệt độ và áp suất.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,1+0,2}.100\%\approx33,33\%\\\%V_{C_2H_4}\approx66,67\%\end{matrix}\right.\)
b, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(n_{Br_2}=n_{C_2H_4}=0,2\left(mol\right)\Rightarrow V_{ddBr_2}=\dfrac{0,2}{0,5}=0,4\left(l\right)=400\left(ml\right)\)

Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
BTNT O, có: \(V_{O\left(trongA\right)}+2V_{O_2}=2V_{CO_2}+V_{H_2O}\Rightarrow V_{O\left(trongA\right)}=0\)
Vậy: A chỉ gồm C và H.
Gọi CTPT của A là CxHy.
\(\Rightarrow\left\{{}\begin{matrix}x=\dfrac{n_{CO_2}}{n_A}=3\\y=\dfrac{2n_{H_2O}}{n_A}=8\end{matrix}\right.\)
Vậy: CTPT cần tìm là C3H8

Giả sử các khí đo ở điều kiện sao cho 1 mol khi có thể tích V lít
\(n_{CO}+n_{CO_2}=\dfrac{20}{V}\)
\(n_{O_2}=\dfrac{8}{V}\left(mol\right)\)
PTHH: 2CO + O2 --to--> 2CO2
_____\(\dfrac{16}{V}\)<---\(\dfrac{8}{V}\)
=> \(\left\{{}\begin{matrix}n_{CO}=\dfrac{16}{V}\\n_{CO_2}=\dfrac{20}{V}-\dfrac{16}{V}=\dfrac{4}{V}\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{\dfrac{16}{V}}{\dfrac{20}{V}}.100\%=80\%\\\%V_{CO_2}=\dfrac{\dfrac{4}{V}}{\dfrac{20}{V}}.100\%=20\%\end{matrix}\right.\)


Gọi công thức hidrocacbon là CxHy
CxHy+O2\(\rightarrow\)CO2+H2O
Sau khi đốt thu được O2 dư, CO2 và H2O
Sau khi làm lạnh thu được 375ml gồm O2 dư và CO2
(H2O bị ngưng tụ)
Dẫn qua KOH thì CO2 phản ứng
CO2+2KOH\(\rightarrow\)K2CO3+H2O
\(\rightarrow\)Khí thu được là O2 dư 175ml
\(\rightarrow\)VCO2=375-175=200ml
Ta có x=VCO2/VCxHy=200/50=4
Ban đầu có 500ml O2, dư 175ml
\(\rightarrow\)O2 phản ứng 500-175=325ml
Theo bảo toàn O: 2VO2=2VCO2+VH2O
\(\rightarrow\)2.325=2.200+VH2O
\(\rightarrow\)VH2O=250ml
\(\rightarrow\)y=2VH2O/VCxHy=2.250/50=10
\(\rightarrow\)Công thức là C4H10