Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_P=\dfrac{6,2}{31}=0,2\left(mol\right)\\ n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,2}{4}< \dfrac{0,4}{5}\Rightarrow O_2dư\)
\(n_{O_2\left(pư\right)}=\dfrac{5}{4}n_P=\dfrac{5}{4}.0,2=0,25\left(mol\right)\\ n_{O_2\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
\(n_{P_2O_5\left(lt\right)}=\dfrac{1}{2}n_P=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{P_2O_5\left(lt\right)}=0,1.142=14,2\left(g\right)\\ m_{P_2O_5\left(tt\right)}=0,1.142.80\%=11,36\left(g\right)\)

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$

\(n_P=\dfrac{6.2}{31}=0.2\left(mol\right)\)
\(n_{O_2}=\dfrac{7.84}{22.4}=0.35\left(mol\right)\)
\(4P+5O_2\underrightarrow{^{^{t^0}}}2P_2O_5\)
\(4........5\)
\(0.2........0.35\)
\(LTL:\dfrac{0.2}{4}< \dfrac{0.35}{5}\Rightarrow O_2dư\)
\(m_{O_2\left(dư\right)}=\left(0.35-0.25\right)\cdot32=3.2\left(g\right)\)
\(m_{P_2O_5}=0.1\cdot142=14.2\left(g\right)\)
Tham khảo nha!!!
nP = 6,2/31 = 0,2 mol ; nO2 = 7,84/22,4 = 0,35 mol
a, PTHH : 4P + 5O2 (to) -> 2P2O5
0,2 0,35 mol
Ta thấy : 0,2/4 < 0,35/5 -> nO2 dư = 0,35 - 0,05*5 = 0,1 mol
-> mO2 dư = 0,1*32 = 3,2 gam
b, Theo pt : nP2O5 = 1/2*nP = 0,1 mol -> mP2O5 = 0,1*142 = 14,2 gam

a)
\(n_{O_2} = \dfrac{11,2}{22,4} = 0,5(mol)\\ 4P + 5O_2 \xrightarrow{t^o} 2P_2O_5\\ n_P = \dfrac{4}{5}n_{O_2} = 0,4(mol)\\ \Rightarrow m_P = 0,4.31 = 12,4(gam)\)
b)
\(n_{P_2O_5} = \dfrac{2}{5}n_{O_2} = 0,2(mol)\\ \Rightarrow m_{P_2O_5} = 0,2.142 = 28,4(gam)\)
c)
\(2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,5.2 = 1(mol)\\ \Rightarrow m_{KMnO_4} = 1.158 = 158(gam)\)

\(n_P=\dfrac{3,1}{31}=0,1\left(mol\right)\)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2mol\)
4P + 5O2 \(\underrightarrow{t^o}\) 2P2O5
\(\dfrac{0,1}{4}< \dfrac{0,2}{5}\) => O2 dư, Photpho đủ
\(n_{O_2}=0,2-0,04=0,16\left(mol\right)\)
\(m_{P_2O_5}=\) 0,05 . 142 = 7,1 ( g )

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\
pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,4 0,2
\(m_{P_2O_5}=142.0,2=28,4g\)
\(n_{O_2}=\dfrac{17}{32}=0,53\left(mol\right)\)
\(pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\
LTL:\dfrac{0,4}{4}< \dfrac{0,53}{5}\)
=> O2 dư
\(n_{O_2\left(p\text{ư}\right)}=\dfrac{5}{4}n_P=0,5\left(mol\right)\\
m_{O_2\left(d\right)}=\left(0,53-0,5\right).32=0,96g\)
`4P + 5O_2` $\xrightarrow[]{t^o}$ `2P_2 O_5`
`0,4` `0,5` `0,2` `(mol)`
`n_P = [ 12,4 ] / 31 = 0,4 (mol)`
`a) m_[P_2 O_5] = 0,2 . 142 = 28,4 (g)`
`b) n_[O_2] = 17 / 32 = 0,53125 (mol)`
Ta có: `[ 0,4 ] / 4 < [ 0,53125 ] / 5`
`->O_2` dư
`=> m_[O_2 (dư)] = ( 0,53125 - 0,5 ) . 32 = 1(g)`

nP = 2,48/31 = 0,08 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 ---> 0,1 ---> 0,04
mP2O5 = 0,04 . 142 = 5,68 (g)
b) nO2 = 4/32 = 0,125 (mol)
So sánh: 0,125 > 0,1 => O2 dư
nO2 (dư) = 0,125 - 0,1 = 0,025 (mol)
mO2 (dư) = 0,025 . 32 = 0,8 (g)
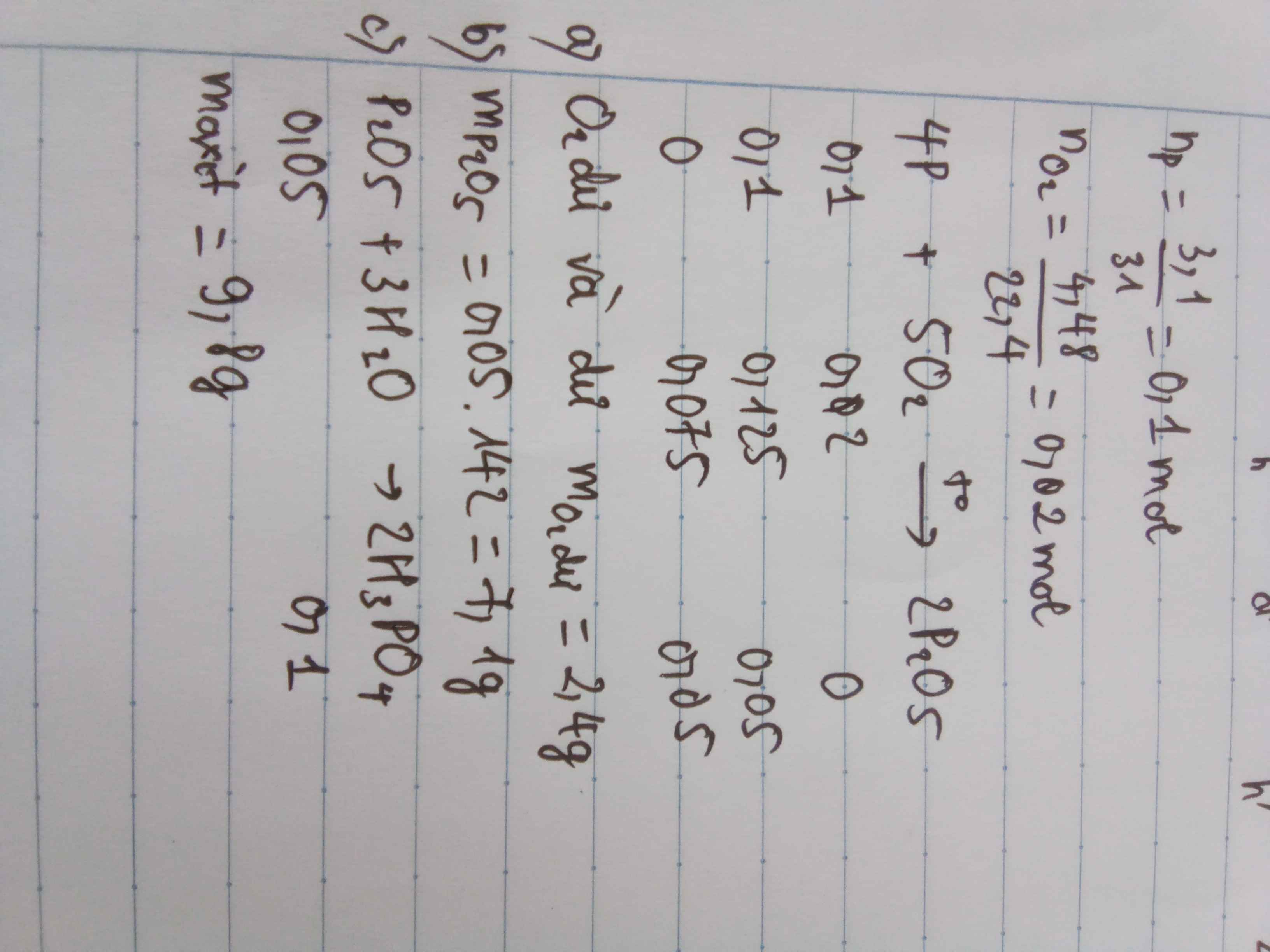

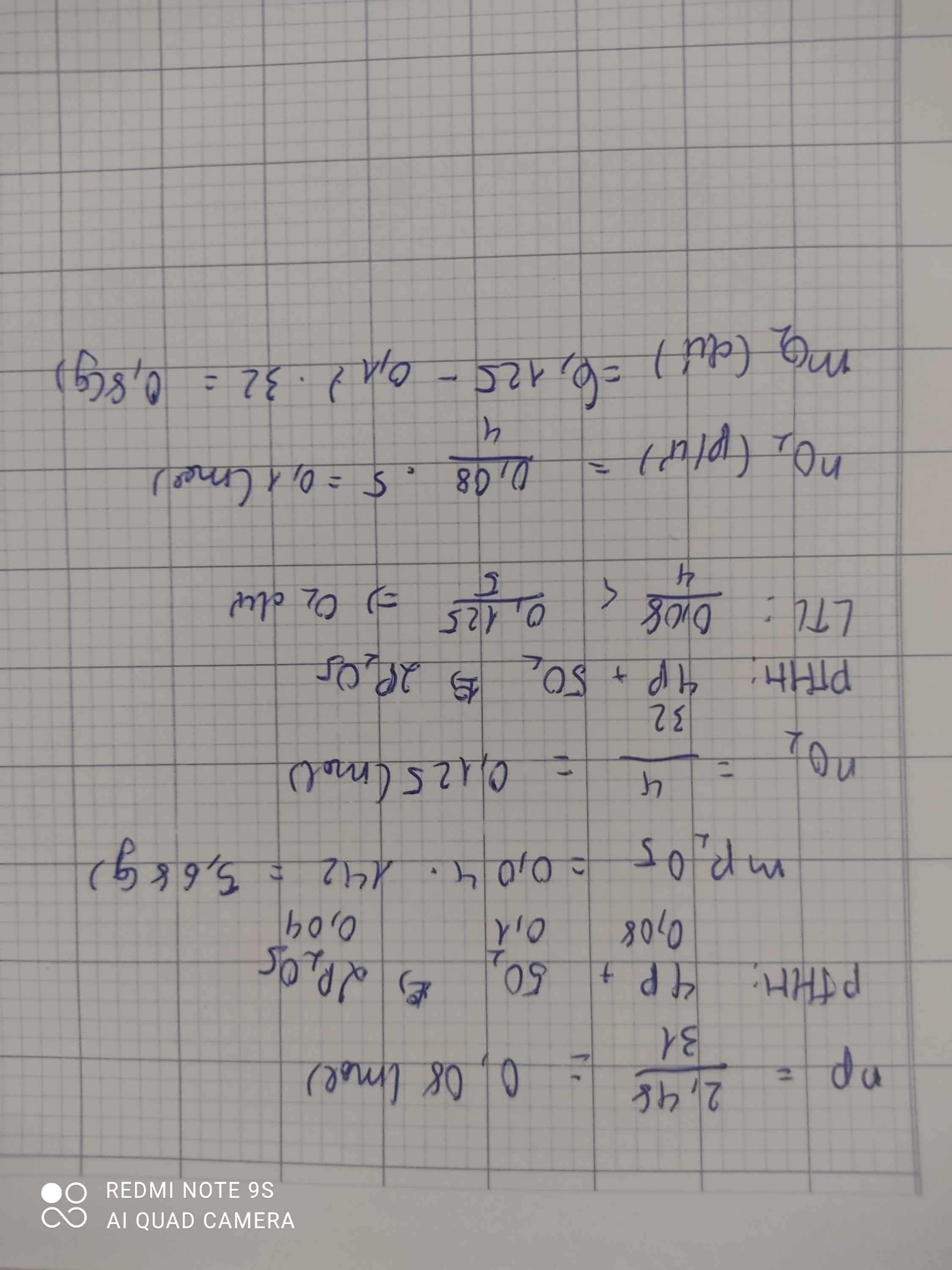
a. \(n_P=\dfrac{12.4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{67.2}{22,4}=3\left(mol\right)\)
Ta thấy : 0,4 < 3 => P đủ , O2 dư
PTHH : 4P + 5O2 -----to-----> 2P2O5
0,4 0,5 0,2
b. \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
sai một chỗ là ta thấy \(\dfrac{0,4}{4}< \dfrac{3}{5}\) nha bạn!!