Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CO\left(dư\right)}=a\left(mol\right)\)
\(n_{CO_2}=b\left(mol\right)\)
\(n_B=a+b=0.5\left(mol\right)\left(1\right)\)
\(m_B=2\cdot20.4\cdot0.5=20.4\left(g\right)\)
\(\Rightarrow28a+44b=20.4\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.4\)
\(n_{CO\left(pư\right)}=n_{CO_2}=0.4\left(mol\right)\)
\(BTKL:\)
\(m_X+m_{CO}=m_A+m_B\)
\(\Leftrightarrow m_X=64+0.4\cdot44-0.4\cdot28=70.4\left(g\right)\)
Các phản ứng khử sắt oxit có thể có:
3Fe2O3 + CO --> 2Fe3O4 + CO2 (1)
Fe3O4 + CO --> 3FeO + CO2 (2)
FeO + CO --> Fe + CO2 (3)
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 hoặc ít hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, quan trọng là số mol CO phản ứng bao giờ cũng bằng số mol CO2 tạo thành. nB = 11,2/22,5 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 x) = 0,5 x 20,4 x 2 = 20,4
nhận được x = 0,4 mol và đó cũng chính là số mol CO tham gia phản ứng.
Theo ĐLBTKL ta có:
mX + mCO = mA + mCO2
--> m = 64 + 0,4 x 44 - 0,4 x 28 = 70,4 gam.

PTHH:
\(CuO+H_2\) \(\underrightarrow{t^o}\) \(Cu+H_2O\) \(\left(1\right)\)
\(Fe_2O_3+3H_2\) \(\underrightarrow{t^o}\) \(2Fe+3H_2O\) \(\left(2\right)\)
Số mol H2 là 0,6 mol
Gọi số mol H2 tham gia pư 1 là x mol \(\left(0,6>x>0\right)\)
Số mol H2 tham gia pư 2 là \(\left(0,6-x\right)mol\)
Theo PTHH 1:
\(n_{CuO}=n_{H_2}=x\left(mol\right)\)
Theo PTHH 2:
\(n_{Fe_2O_3}=\frac{1}{3}n_{H_2}=\left(0,6-x\right):3\left(mol\right)\)
Theo bài khối lượng hh là 40g
Ta có pt: \(80x+\left(0,6-x\right)160:3=40\)
Giải pt ta được \(x=0,3\)
Vậy \(n_{CuO}=0,3\left(mol\right);n_{Fe_2O_3}=0,1\left(mol\right)\)
\(\%m_{CuO}=\left(0,3.80.100\right):40=60\%\)
\(\%m_{Fe_2O_3}=\left(0,1.160.100\right):40=40\%\)
1)
PTHH: \(2Cu+O_2\) \(\underrightarrow{t^o}\) \(2CuO\)
x x
Gọi số mol Cu phản ứng là x mol ( x >0)
Chất rắn X gồm CuO và Cu
Ta có PT: 80x + 25,6 – 64x = 28,8
Giải PT ta được x = 0,2
Vậy khối lượng các chất trong X là:
\(m_{Cu}\) = 12,8 gam
\(m_{CuO}\) = 16 gam
2)
Gọi kim loại hoá trị II là A.
PTHH: \(A+2HCl\rightarrow ACl_2+H_2\)
Số mol \(H_2\)= 0,1 mol
Theo PTHH: \(n_A=n_{H_2}\)= 0,1 (mol)
Theo bài \(m_A\) = 2,4 gam \(\Rightarrow\) \(M_A\) = 2,4 : 0,1 = 24 gam
Vậy kim loại hoá trị II là Mg

B gồm CO(a mol) ; CO2( b mol)
Ta có:
\(n_B = a + b = \dfrac{11,2}{22,4}=0,5(mol)\\ m_B = 28a + 44b = 0,5.2.20,4 = 20,4(gam)\\ \Rightarrow a = 0,1 ; b = 0,4\\ CO + O_{oxit} \to CO_2\\ n_O = n_{CO_2} = 0,4(mol)\\ \Rightarrow m = m_A + m_{O\ pư} = 6,4 + 0,4.16 = 12,8(gam)\)
Các phản ứng khử sắt oxit có thể có:
3Fe2O3 + CO --> 2Fe3O4 + CO2 (1)
Fe3O4 + CO --> 3FeO + CO2 (2)
FeO + CO --> Fe + CO2 (3)
Như vậy chất rắn A có thể gồm 3 chất Fe, FeO, Fe3O4 hoặc ít hơn, điều đó không quan trọng và việc cân bằng các phương trình trên cũng không cần thiết, quan trọng là số mol CO phản ứng bao giờ cũng bằng số mol CO2 tạo thành. nB = 11,2/22,5 = 0,5 mol
Gọi x là số mol của CO2 ta có phương trình về khối lượng của B:
44x + 28(0,5 x) = 0,5 x 20,4 x 2 = 20,4
nhận được x = 0,4 mol và đó cũng chính là số mol CO tham gia phản ứng.
Theo ĐLBTKL ta có:
mX + mCO = mA + mCO2
--> m = 64 + 0,4 x 44 - 0,4 x 28 = 70,4 gam.

Khí B gồm : $CO(a\ mol) ; CO_2(b\ mol)$
Ta có :
$a + b = \dfrac{11,2}{22,4} = 0,5(mol)$
$M_B = \dfrac{28a + 44b}{a + b} = 20,4.2$
Suy ra : a = 0,1 ; b = 0,4
$CO + O_{oxit} \to CO_2$
$n_{O(oxit)\ pư} = n_{CO_2} = 0,4(mol)$
$\Rightarrow m = m_A + m_O = 64 + 0,4.16 = 70,4(gam)$

\(S+O_2\underrightarrow{t^o}SO_2\)
\(1:1:1:1\)
\(0,2:0,2:0,2:0,2\left(mol\right)\)
\(n_{SO_2}=\dfrac{V}{24,79}=\dfrac{4,958}{24,79}=0,2\left(mol\right)\)
\(a,m_S=n.M=0,2.32=6,4\left(g\right)\)
\(b,V_{O_2}=n.24,79=0,2.24,79=4,958\left(l\right)\)
làm lại ko để ý có điều kiện=))))
\(n_{SO_2\left(dkc\right)}=\dfrac{V}{24,79}=\dfrac{4,958}{24,79}=0,2\left(mol\right)\)
\(PTHH:S+O_2-^{t^o}>SO_2\)
tỉ lệ 1 : 1 : 1
n(mol) 0,2<--0,2<---0,2
\(m_S=n\cdot M=0,2\cdot32=6,4\left(g\right)\\ V_{O_2\left(dkc\right)}=n\cdot24,79=0,2\cdot24,79=4,958\left(l\right)\)

Hỗn hợp khí sau phản ứng gồm CO;CO2
2C+O2to→2CO
C+O2→toCO2
Mhh¯=19MH2=19.2=38
Áp dụng quy tắc đường chéo:
CO(28) 6
hh(38)
CO2(44) 10
→nCO\nCO2=6\10=3\5
→%nCO=3\3+5=37,5%→%nCO2=62,5%
Giả sử số mol CO là 3a suy ra số mol CO2 là 5a.
→nO2=1\2nCO+nCO2=3a\2+5a=6,5a=32\32=1
→a=2\13→nC=nCO2+nCO=2a=4\13→mC=4\13.12=3,692 gam = x

a) M khí = 15,412.2 =30,824
m C pư = 12 - 10,68 = 1,32(gam)
b) n O2 = c(mol) ; n N2 = d(mol)
=> c + d = 0,5(1)
n C(pư) = (12 - 10,68)/12 = 0,11(mol)
Khí sau phản ứng gồm :
CO(a mol) ; CO2(b mol) và N2(d mol)
Ta có :
28a + 44b + 28d = (a + b + d).30,824 (2)
Bảo toàn nguyên tố với C : a + b = 0,11 (3)
Bảo toàn nguyên tố với O : a + 2b = 2c (4)
Từ (1)(2)(3)(4) suy ra a = 0,02 ; b = 0,09 ; c = 0,1 ; d = 0,4
Vậy :
m CO = 0,02.28 = 0,56(gam)
m CO2 = 0,09.44 = 3,96(gam)
m N2 = 0,4.28 = 11,2(gam)

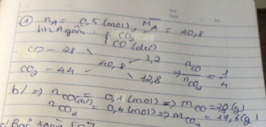
Hỗn hợp khí thu được gồm: CO và CO2
Ta có: \(\left\{{}\begin{matrix}n_{CO}+n_{CO_2}=\dfrac{4,958}{24,79}=0,2\\28n_{CO}+44n_{CO_2}=19.2.0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_{CO}=0,075\left(mol\right)\\n_{CO_2}=0,125\left(mol\right)\end{matrix}\right.\)
PT: \(C+\dfrac{1}{2}O_2\underrightarrow{t^o}CO\)
\(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_C=n_{CO}+n_{CO_2}=0,2\left(mol\right)\)
⇒ mC = 0,2.12 = 2,4 (g)