Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ban đầu:\(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=0,25.\left(0,08+2.0,01\right)=0,025\left(mol\right)\)
\(n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,25a.2=0,5a\)
\(n_{Ba^{2+}}=n_{Ba\left(OH\right)_2}=0,25a\); \(n_{SO_4^{2-}}=n_{H_2SO_4}=0,0025\left(mol\right)\)
Dung dịch sau phản ứng có pH = 12 => pOH = 2
\(\Rightarrow\left[OH^-\right]=10^{-2}=0,01\left(M\right)\Rightarrow n_{OH^-}=0,01.0,5=0,005\left(mol\right)\)Vì pH = 12 > 7 nên \(H^+\) hết, \(OH^-\) còn.
\(H^++OH^-\rightarrow H_2O\)
0,025-->0,025
=> \(n_{OH^-}\text{còn}=0,5a-0,025=0,005\Rightarrow a=0,06\left(mol\text{/}l\right)\)
Từ đó suy ra được \(n_{Ba^{2+}}=0,25.0,06=0,015\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\downarrow\)
0,0025<--0,0025
=> \(m=m_{BaSO_4}=0,0025.233=0,5825\left(gam\right)\)

Đáp án B
nCaCO3 = 0,18 mol
nCa(OH)2 = 0,24 mol
BTNT “Ca” ta có: nCa(HCO3)2 = nCa(OH)2 – nCaCO3 = 0,24 – 0,18 = 0,06 mol
BTNT “C”: nCO2 = nCaCO3 + 2nCa(HCO3)2 = 0,18 + 2.0,06 = 0,3 mol => nC = 0,3 mol
Mặt khác, m dd tăng = mCO2 + mH2O – mCaCO3 => 2,4 = 0,3.44 + mH2O – 18
=> mH2O = 7,2 gam => nH2O = 0,4 mol => nH = 0,8 mol
mO(hchc) = mhchc – mC – mH = 9,2 – 0,3.12 – 0,8.1 = 4,8 gam => nO = 4,8 : 16 = 0,3 mol
C : H : O = 0,3 : 0,8 : 0,3 = 3 : 8 : 3
=> CTPT (C3H8O3)n hay C3nH8nO3n
Trong hchc ta luôn có: H ≤ 2C + 2 => 8n ≤ 2.3n + 2 => n ≤ 1
=> n = 1
Vậy CTPT của hchc là C3H8O3

Đáp án D
Thí nghiệm 1: Khi cho từ từ dung dịch HCl vào muối cacbonat xảy các phương trình theo thứ tự sau:
H+ + CO32- → HCO3- (1)
Sau khi (1) xảy ra nếu H+ dư thì HCO3- + H+ → CO2 + H2O (2)
Thí nghiệm 2: Nhận thấy khi cho dung dịch Ca(OH)2 vào dung dịch thu được của thí nghiệm 1 thấy tạo kết tủa → trong dung dịch còn ion HCO3- : 0,03 mol ( HCO3- + OH- → CO32- )
Bảo toàn nguyên tố C ta có : nmuối = nHCO3- + nCO2 = 0,03 + 0,015 = 0,045 mol
→ Mtb muối =
5
,
25
0
,
045
= 116,67→ 2 muối cacbonat của kim loại kiềm kế tiếp là Na2CO3 và K2CO3
Ta có nH+ = nCO32- + nCO2 = 0,045 + 0,015 = 0,06 mol
Dung dịch HCl có pH = 0 → CMHCl = 1 M → VHCl = 0,06 lít

Đáp án C
Ta có: n N a 2 C O 3 = 1,2.0,1= 0,12 mol;
n N a H C O 3 = 0,1.0,6= 0,06 mol;
nHCl = 0,2 mol
Thêm từ từ hỗn hợp Na2CO3 và NaHCO3 vào HCl
CO32- + 2H+ → CO2 + H2O
0,12 → 0,24
HCO3- + H+ → CO2 + H2O
0,06 → 0,06
Nếu phản ứng xảy ra vừa đủ thì cần 0,24 + 0,06 = 0,3 mol H+ > 0,2 mol
→ H+ bị thiếu
Đặt n C O 3 2 - pứ = x mol; n H C O 3 - pứ = y mol
CO32- + 2H+ → CO2 + H2O
x → 2x
HCO3- + H+ → CO2 + H2O
y → y
Ta có: n H + = 2x+ y = 0,2 mol
x y = n C O 3 2 - n H C O 3 - = 0 , 12 0 , 06 = 2
→ x-2y = 0
Giải hệ trên ta có : x = 0,08 mol ; y = 0,04 mol
Dung dịch X chứa 0,12-x = 0,04 mol CO32- và 0,06-y = 0,02 mol HCO3-
HCO3-+ OH- → CO32-+ H2O
0,02 0,02
Tổng số mol CO32- là 0,02+ 0,04 = 0,06 mol
CO32-+ Ca2+ → CaCO3
0,06 0,06 mol
→ m C a C O 3 = 0,06.100 = 6 gam

Đáp án D
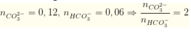
Khi cho từ từ dung dịch trên vào HCl thì cả CO3 2- và HCO3- sẽ phản ứng để tạo khí (do cho từ từ nên lượng H+ luôn lớn hơn rất nhiều lượng CO3 2- và HCO3-) theo tỉ lệ số mol các chất
Giả sử có x mol HCO3- phản ứng, suy ra có 2x mol CO3 2- phản ứng![]()
Như vậy, sau phản ứng, còn lại: 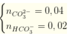
Cho vào nước vôi trong thì sẽ thu được ![]()
⇒ m=6
=> Đáp án D
\(n_{H_2}=0,1\left(mol\right)\)
\(H_2\left(0,1\right)+Cl_2-t^o->2HCl\left(0,2\right)\)
\(\Rightarrow n_{HCl}=0,2\left(mol\right)\)
\(n_{Ca\left(OH\right)_2}=0,125\left(mol\right)\)\(\Rightarrow n_{OH^-}=0,25\left(mol\right)\)
\(H^+\left(0,2\right)+OH^-\left(0,2\right)\rightarrow H_2O\)
\(\Rightarrow n_{OH^-}\left(dư\right)=0,05\left(mol\right)\)
\(\Rightarrow\left[0H^-\right]=0,01\left(M\right)\)
\(\Rightarrow pH=14-pOH=14-2=12\)