Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nS = 9,6/32 = 0,3 mol
S + O2 ---to----> SO2
0,3__0,3__________0,3
mSO2 = 0,3 . 64 = 19,2 (g)
VO2 = 0,3 . 22,4 = 6,72 (l)
Vkk = 6,72 . 5 = 33,6 (l)

S+O2-to>SO2
0,2--0,2----0,2 mol
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>VO2=0,2.22,4=4,48l

a) \(n_S=\dfrac{16}{32}=0,5\left(mol\right)\)
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> mSO2 = 0,5.64 = 32 (g)
b) VO2 = 0,5.22,4 = 11,2 (l)
=> Vkk = 11,2.5 = 56 (l)
c)
\(n_{O_2}=\dfrac{24}{32}=0,75\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,5}{1}< \dfrac{0,75}{1}\)
=> S hết, O2 dư
PTHH: S + O2 --to--> SO2
0,5->0,5------>0,5
=> nO2(dư) = 0,75 - 0,5 = 0,25 (mol)

\(n_S=\dfrac{m_S}{M_S}=\dfrac{1,6}{32}=0,05mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{9,6}{32}=0,3mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,05 < 0,3 ( mol )
0,05 0,05 0,05 ( mol )
Chất còn dư là O2
\(m_{O_2\left(du\right)}=n_{O_2\left(du\right)}.M_{O_2}=\left(0,3-0,05\right).32=8g\)
\(m_{SO_2}=n_{SO_2}.M_{SO_2}=0,05.64=3,2g\)

a) PTHH : \(S+O_2->SO_2\)
b) Ta có : \(n_S\) = \(\dfrac{m_S}{M_S}\) = 0.1 (mol)
Có : \(n_S=n_{O_2}\)
--> \(n_{O_2}\) = 0.1 (mol)
=> \(V_{O_2\left(đktc\right)}\) = \(n_{O_2}\) . 22.4 = 2.24 (L)
\(n_S=\dfrac{3,2}{32}=0,1\left(mol\right)\\ PTHH:S+O_2\underrightarrow{t^o}SO_2\\ \left(mol\right)..0,1\rightarrow0,1..0,1\\ V_{O_2}=0,1.22,4=2,24\left(l\right)\)

\(n_{hhkhí}=\dfrac{16,8}{22,4}=0,75\left(mol\right)\)
Gọi \(n_{SO_2}=a\left(mol\right)\left(0< a< 0,75\right)\)
\(\rightarrow n_{O_2\left(dư\right)}=0,75-b\left(mol\right)\)
Ta có: \(\dfrac{64a+32\left(0,75-a\right)}{0,75}=\dfrac{33,6}{1}=33,6\left(\dfrac{g}{mol}\right)\)
\(\rightarrow a=0,0375\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}\%V_{SO_2}=\dfrac{0,0375}{0,75}=5\%\\\%V_{O_2\left(dư\right)}=100\%-5\%=95\%\end{matrix}\right.\)

Bài 1 :
Khối lượng FeS thu được sau phản ứng biết lưu huỳnh dư 1,6 g :
mFe = mFe + mS - mS.dư
= 2,8 + 3,2 - 1,6
= 4,4 (g)
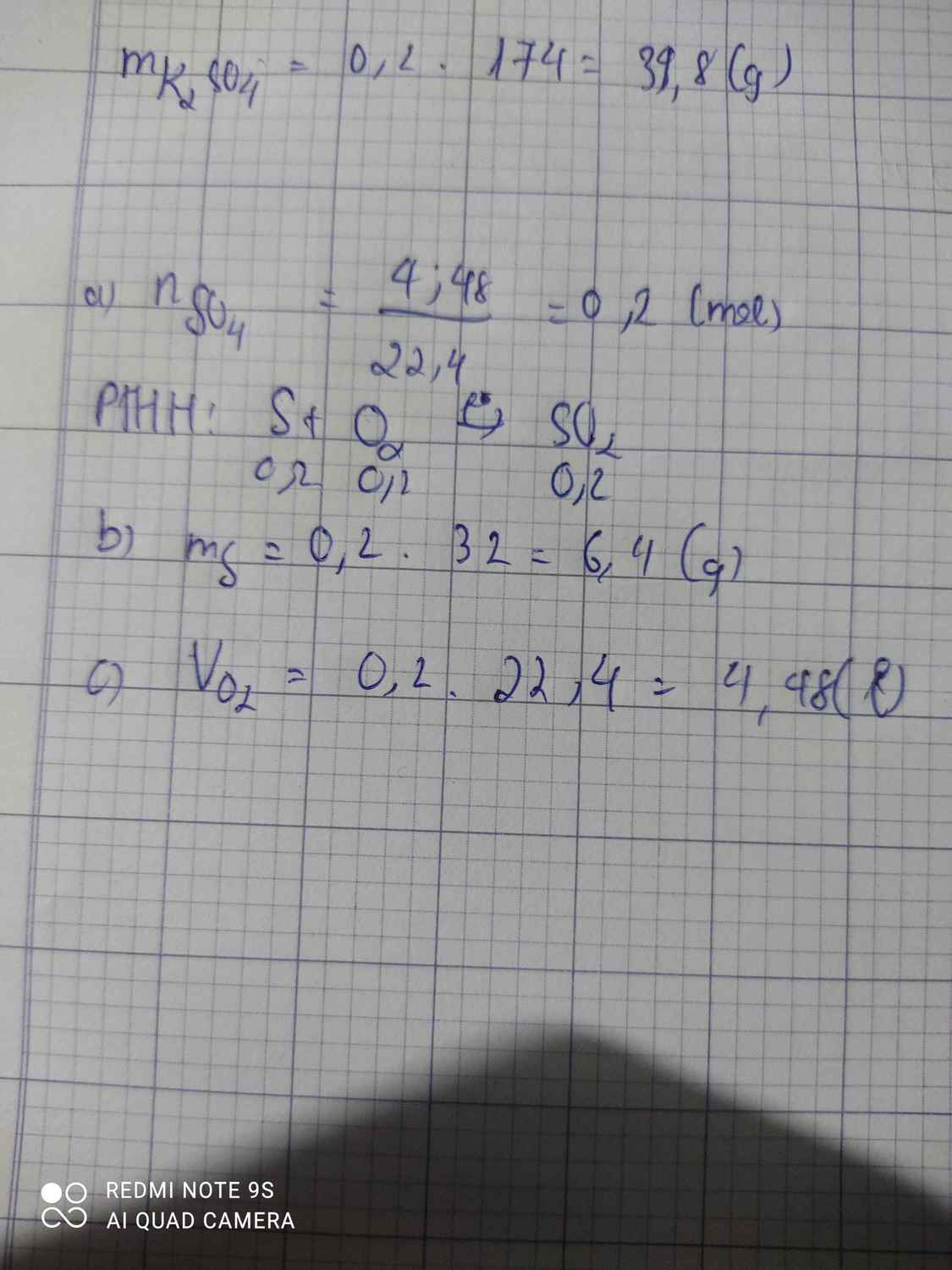
a. PTHH: 4FeS2 + 11O2 ---to---> 2Fe2O3 + 8SO2
b. Ta có: \(n_{SO_2}=\dfrac{32}{64}=0,5\left(mol\right)\)
=> \(m_{S_{\left(FeS_2\right)}}=m_{S_{\left(SO_2\right)}}=0,5.32=16\left(g\right)\)
=> \(\%_{m_{S_{\left(FeS_2\right)}}}=\dfrac{16}{20}.100\%=80\%\)
PTHH : S + O2 ------> SO2
Áp dụng định luật bảo toàn khối lượng ta có :
mS + mO2 = mSO2
=> mS= mSO2- mO2
=32-16 = 16 (g)
Thành phần % khối lượng lưu huỳnh có trong mẫu quặng đó là
%mS = 16:32.100%=50%