Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
Dung dịch X bị điện phân đến khi xuất hiện bọt khí ở catot thì dừng ⇒ Cu2+ đã điện phân hết và catot chỉ còn H+ ⇒ Y chỉ chứa HNO3, còn 2 khí có số mol 0,44 mol tại anot là Cl2 và O2


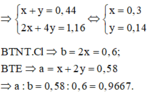

Đáp án A
Quy hỗn hợp thành Fe2O3, FeO và CuO với số mol lần lượt là a b và c.
Ta có sơ đồ phản ứng:
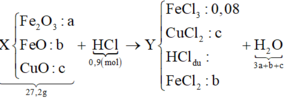
Khi điện phân dung dịch Y đến khi catot thoát khí ⇒ FeCl3 và CuCl2 đã bị điện phân hết.
⇒ mGiảm = nFeCl3×35,5 + nCuCl2×135 = 13,64 gam Û nCuCl2 = 0,08 mol.
⇒ Ta có hệ phương trình
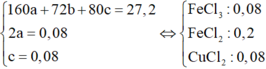
Bảo toàn Clo ⇒ nHCl dư = 0,1 mol.
●Tóm lại sau điện phân dung dịch chứa: nFeCl2 = 0,28 mol và nHCl = 0,1 mol.
Cho dung dịch sau điện phân + AgNO3 ⇒ 3Fe2+ + 4H+ + NO3– → Fe3+ + NO + 2H2O.
⇒ nFe2+ bị mất đi = 0,1 × 3 ÷ 4 = 0,075 mol ⇒ nFe2+ còn lại = 0,28 – 0,075 = 0,205 mol.
⇒ nAg = nFe2+ = 0,205 mol || nAgCl = nCl– = 0,28×2 + 0,1 = mol.
⇒ m↓ = mAg + mAgCl = 0,205×108 + 0,66×143,5 = 116,85

Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.

Chọn A.
Gọi a, b lần lượt là số mol Cu(NO3)2 và AgNO3.
Ta có: 2a + b = (0,402.4): 26,8 = 0,06 (1)
mCu, Ag = 64a + 108b = 3,44 (2)
Từ (1) và (2): a = 0,02; b = 0,02.

Các ion tham gia điện phân ở catot theo thứ tự tính oxi hóa từ mạnh đến yếu (Fe3+ > Cu2+ > H+ > Fe2+).
Khi ở catot bắt đầu thoát khí (tức H+ chỉ mới bắt đầu điện phân)
=> Fe3+ chỉ bị khử thành Fe2+ và Cu2+ bị khử hoàn toàn) => n(e trao đổi)=0,1.2+0,2.1=0,4
=> n(Cl2 ) = 0,2 => V = 4,48 (lít) => Đáp án B






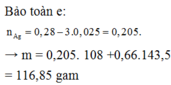
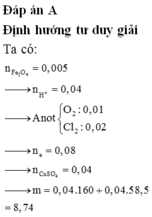
Đáp án C