Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

Phản ứng điện phân xảy ra ở các điện cực như sau:
Catot(-):Ag+ + e → Ag; Anot(+): H2O - 2e → 1/2O2 + 2H+
x x x (mol)
Dung dịch Y có chứa: H+, NO3- và Ag+ dư → Fe + 2Ag+ → 2Ag + Fe2+
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O (do Fe dư nên chỉ tạo Fe2+)
nAgNO3 = 0,15 mol; nFe = 12,6/56 = 0,225 mol;
Gọi x là số mol Ag+ đã bị điện phân → nAg+ dư = 0,15 – x mol → số mol Fe dư = 0,225 – (0,15-x)/2 – 3x/8 = 0,15 + x/8 → 108(0,15-x) + 56(0,15+x/8) = 14,5 → x = 0,1 mol → t = 0,1.26,8/2,68 = 1 h.

Căn cứ vào các tính chất của các halogen ta thấy chỉ có C3H7Cl phản ứng được với dung dịch NaOH đun nóng. Đặt công thức của Y là RCl, phương trình phản ứng :
C3H7Cl + NaOH = C3H7OH + NaCl (1)
mol: x x
AgNO3 + NaCl = AgCl + NaNO3 (2)
mol: x x
Theo (1), (2) và giả thiết ta có :
nC3H7Cl = nNaCl = nAgCl = 1,435/143,5 = 0.01 mol;
mC6H5Cl = 1,91 - 0,01.78,5 = 1,125 gam.

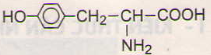 với các chất sau:
với các chất sau: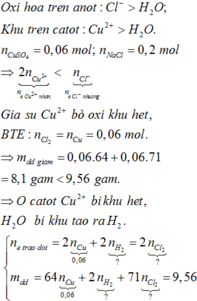
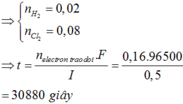
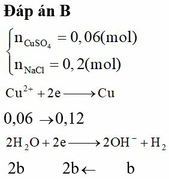
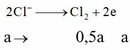
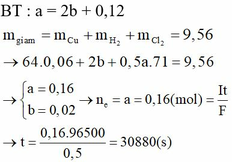
Giải thích: Đáp án C
nMgCl2 = nNaCl = 0,2 mol => ∑nCl- = 0,2.2 + 0,2 = 0,6 mol
Tại catot: xảy ra quá trình oxi khử H2O Tại anot: Xảy ra quá trình oxi hóa Cl-
2H2O +2e → H2 + 2OH- 2Cl- → Cl2 + 2e
0,3 → 0,15 → 0,3 0,15←0,3
Khối lượng giảm = m↓ + m↑
= mMg(OH)2 + mH2 + mCl2
= 0,15.58 + 0,15.2 + 0,15.71 = 19,65g
Chú ý:
Tính khối lượng kết tủa của Mg(OH)2