
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
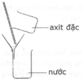
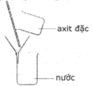
H2SO4 hòa tan vô hạn trong nước và tỏa nhiều nhiệt. Vì vậy khi pha loãng axit sunfuric đặc cần phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại.
Vậy X là H2SO4.

Đáp án B
H2SO4 tan vô hạn trong nước và tỏa nhiều nhiệt. Vì vậy khi pha loãng axit sunfuric đặc cần phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại. Vậy X là H2SO4

refer
Khi axit sunfuric gặp nước thì lập tức sẽ có phản ứng hóa học xảy ra, đồng thời sẽ tỏa ra một nhiệt lượng lớn. Axit sunfuric đặc giống như dầu và nặng hơn trong nước. Nếu bạn cho nước vào axit, nước sẽ nổi trên bề mặt axit. Khi xảy ra phản ứng hóa học, nước sôi mãnh liệt và bắn tung tóe gây nguy hiểm.

Bài 1)
Mg(OH)2 + H2SO4 => MgSO4 + 2H20
Bài 2)
sinh ra dd ko màu thì chỉ có Al2O3 thôi
Bài 3)
MgO + 2HNO3 => Mg(NO3)2 + H2O
Bài 4)
phương pháp hóa học
+ lấy hh Fe, Cu tác dụng với HCl
Fe +2 HCl => FeCl2 + H2
+ còn đồng ko tác dụng dc với HCl : ta lọc đồng ra khỏi hh òi phơi khô. Ta giả định cho đồng là 4g => mFe = 6g
% Cu = 4*100/10 = 40(%)
% Fe = 100- 40= 60 (%)
phương pháp vật lý
dùng nam châm hút sắt ra khỏi hỗn hợp. Ta có mFe là 6g => m Cu = 4 (g)
% Cu = 4*100/10 = 40(%)
% Fe = 100-40 = 60(%)

1.
a/ - Cho dd H2SO4 loãng t/d với Fe.
Fe + H2SO4 -> FeSO4 + H2O
=> H2SO4 có tính chất hóa học (tchh) của axit: t/d với KL đứng trước H sinh ra muối và khí H2.
- Cho dd H2SO4 l~t/d với CuO.
CuO + H2SO4 -> CuSO4 + H2O
=> H2SO4 có tchh của axit: t/d với oxit bazơ tạo ra muối và nước.
- Cho dd H2SO4 t/d với KOH.
2KOH + H2SO4 -> K2SO4 + 2H2O
=> H2SO4 có tchh của axit: t/d với dd kiềm cho ra muối và nước.
b/ - Cho H2SO4 đặc t/d với Cu.
Cu + 2H2SO4 đ --t*--> CuSO4 + SO2 + 2H2O
=> H2SO4 đặc có tchh riêng: t/d được với Cu, sinh ra khí SO2 (KL đứng sau H).
- Cho H2SO4 đặc t/d với Fe.
2Fe + 6H2SO4 đ --t*--> Fe2(SO4)3 + 6H2O + 3SO2
=> H2SO4 đặc có tchh riêng: t/d với KL sinh ra muối và giải phóng SO2; đẩy được Fe lên hóa trị cao nhất.
- Cho H2SO4 đặc vào C6H12O6.
C6H12O6 ----H2SO4 đ, t*---> 6C + 6H2O
=> H2SO4 đặc có tchh riêng: có tính háo nước.
2. Gọi số mol của CuO và ZnO lần lượt là a và b.
n HCl = Cm.V = 3.0,1 = 0,3 mol.
a/ CuO + 2HCl -> CuCl2 + H2O
_1_____2 (mol)
_a_____2a
ZnO + 2HCl -> ZnCl2 + H2O
_1______2 (mol)
_b_____2b
Theo đề bài, ta có hệ phương trình:
80a + 81b = 12,1 (m hh)
2a + 2b = 0,3 (n HCl)
Giải hệ, được: a = 0,05; b = 0,1.
b/ m CuO = n.M = 80a = 80.0,05 = 4 (g).
=> % mCuO = (mCuO / mhh) . 100% = 33,06 %.
=> % mZnO = 100% - 33,06% = 66,94 %.
c/ CuO + H2SO4 -> CuSO4 + H2O
___1______1 (mol)
___0,05__0,05
ZnO + H2SO4 -> ZnSO4 + H2O
_1_____1 (mol)
_0,1__0,1
Tổng số mol H2SO4 = 0,05 + 0,1 = 0,15 mol.
=> m H2SO4 = n.M = 0,15.98 = 14,7 g.
=> mdd H2SO4 = (mct.100%) / C% = (14,7.100)/20 = 73,5 g.

Công thức cấu tạo (trái) và công thức electron (phải) của :
\(BeCl_2\):
Cl → Be Cl ← :Cl::Be::Cl: .. ..
\(NH_3\):
H – N – H H H:N:H .. .. H
\(H_2O\):
H – O – H H:O:H .. ..
\(O_2\):
O = O :O::O: .. ..
\(SO_2\):
O = S → O :O::S:O: .. .. .. ..

a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 → BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu → CuSO4 + SO2 + 2H2O
2H2SO4 + S → 3SO2 + 2H2O
2H2SO4 + 2KBr → Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 → 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng
a) Dung dịch axit sunfuric loãng có những tính chất chung của axit, đó là:
- Đổi màu quỳ tím thành đỏ.
- Tác dụng với kim loại giải phóng hiđro.
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
- Tác dụng với oxit bazơ và bazơ
Ba(OH)2 + H2SO4 \(\rightarrow\) BaSO4 + 2H2O
- Tính chất với nhiều chất muối
BaCl2 + H2SO4 \(\rightarrow\) BaSO4 +2HCl
b) Tính chất hóa học đặc trưng của axit sunfuric đặc là tính oxi hóa mạnh và tính háo nước.
- Tính chất oxi hóa mạnh
2H2SO4 + Cu \(\rightarrow\) CuSO4 + SO2 + 2H2O
2H2SO4 + S \(\rightarrow\) 3SO2 + 2H2O
2H2SO4 + 2KBr \(\rightarrow\) Br2 + SO2 + 2H2O + K2SO4
- Tính háo nước và tính chất oxi hóa
Axit sunfuric đặc háp thụ mạnh nước. Axit sunfuric đặc chiếm các nguyên tử H và O là những nguyên tố thành phần của các hợp chất gluxit giải phóng cacbon và nước.
C12H22O11 \(\rightarrow\) 12C + 11H2O.
Da thịt tiếp xúc với H2SO4 đặc sẽ bị bỏng rất nặng, vì vậy khi sử dụng axit sunfuric phải hết sức thận trọng.

a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng
a) Thể tích nước cần dùng để pha loãng.
Khối lượng của 100ml dung dịch axit 98%
100ml × 1,84 g/ml = 184g
Khối lượng H2SO4 nguyên chất trong 100ml dung dịch trên
Khối lượng dung dịch axit 20% có chứa 180,32g H2SO4 nguyên chất.
Khối lượng nước cần bổ sung vào 100ml dung dịch H2SO4 98% để có được dung dịch 20%.
901,6g – 184g = 717,6g
Vì D của nước là 1 g/ml nên thể tích nước cần bổ sung là 717,6 ml.
b) Cách tiến hành khi pha loãng
Khi pha loãng lấy 717,6 ml H2O vào ống đong hình trụ có thể tích khoảng 2 lít. Sau đó cho từ từ 100ml H2SO4 98% vào lượng nước trên, đổ axit chảy theo một đũa thủy tinh, sau khi đổ vài giọt nên dùng đũa thủy tinh khuấy nhẹ đều. Không được đổ nước vào axit 98%, axit sẽ bắn vào da, mắt ... và gây bỏng rất nặng

Chọn A
Nồng độ các chất phản ứng ở cốc (1) lớn hơn ở cốc (2) → Thời gian xuất hiện kết tủa trắng đục của cốc (1) ít hơn cốc (2).

Xét hiệu độ âm điện :
\(P_2O_5\): \(3,44-2,19=1,25>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(HAt\): \(2,20-2,2=0< 0,4\text{ }\Rightarrow\)Liên kết cộng hoá trị không cực.
\(C_3O_2\): \(3,44-2,55=0,89>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(CsF\): \(3,98-0,79=3,19>1,7\text{ }\Rightarrow\) Liên kết ion.
\(NaCl\): \(3,16-0,93=2,23>1,7\text{ }\Rightarrow\) Liên kết ion.
\(CaO\): \(3,44-1,00=2,44>1,7\text{ }\Rightarrow\) Liên kết ion.
\(PN\): \(3,04-2,19=0,85>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
\(ClF_3\): \(3,98-3,16=0,82>0,4\&< 1,7\text{ }\Rightarrow\) Liên kết cộng hoá trị có cực.
Đáp án A
Muốn pha loãng H 2 SO 4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh mà không được làm ngược lại