Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong hỗn hợp khí, Gọi $n_{CO} = a(mol) ; n_{CO_2} = b(mol)$
Ta có :
$a + b = \dfrac{1,344}{22,4} = 0,06(mol)$
$28a + 44b = (a + b)9.4$
Suy ra a = b = 0,03
$CO + O_{oxit} \to CO_2$
$n_O = n_{CO_2} = 0,03(mol)$
$\Rightarrow n_{Fe} = \dfrac{1,6 - 0,03.16}{56} = 0,02(mol)$
$n_{Fe} : n_O = 0,02 : 0,03 = 2 : 3$
Vậy oxit là $Fe_2O_3$
Khí thu được gồm CO dư và CO2.
PT: \(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\)
Ta có: \(n_{CO\left(banđau\right)}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{CO\left(dư\right)}=a\left(mol\right)\\n_{CO_2}=b\left(mol\right)\end{matrix}\right.\)
⇒ a + b = 0,06 (1)
Mà: Tỉ khối hhk so với He bằng 9
⇒ 28a + 44b = 9.4.0,06 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,03\left(mol\right)\\b=0,03\left(mol\right)\end{matrix}\right.\)
⇒ nCO (pư) = 0,03 (mol)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{y}n_{CO}=\dfrac{0,03}{y}\left(mol\right)\)
\(\Rightarrow M_{Fe_xO_y}=\dfrac{1,6}{\dfrac{0,03}{y}}=\dfrac{160}{3}y\left(g/mol\right)\)
\(\Rightarrow56x+16y=\dfrac{160}{3}y\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: Oxit đó là Fe2O3.
Bạn tham khảo nhé!

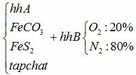
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
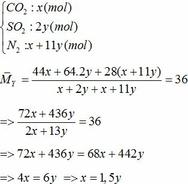
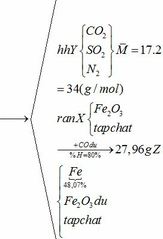
Khối lượng Fe có trong Z là:
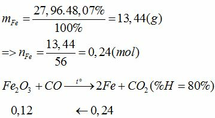
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
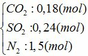
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
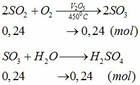
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
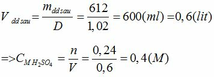

a, Gọi: \(\left\{{}\begin{matrix}n_{FeO}=a\left(mol\right)\\n_{CuO}=b\left(mol\right)\end{matrix}\right.\) (trong 1 phần)
- Phần 1: \(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Ta có: \(n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{FeO}+n_{CuO}=a+b=0,4\left(1\right)\)
- Phần 2: Khí thoát ra khỏi ống gồm CO dư và CO2.
Ta có: \(M_{hhk}=1,275.32=40,8\left(g/mol\right)\)
\(\Rightarrow n_{hhk}=n_{CO\left(dư\right)}+n_{CO_2}=\dfrac{10,2}{40,8}=0,25\left(mol\right)\)
BTNT C, có: nCO = nCO (dư) + nCO2 = 0,25 (mol)
Theo ĐL BTKL, có: mFeO + mCuO + mCO = mK + mhhk
⇒ 72a + 80b + 0,25.28 = 28 + 10,2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,3\left(mol\right)\end{matrix}\right.\)
Do chia A thành 2 phần bằng nhau nên %m mỗi chất trong từng phần cũng là %m mỗi chất trong A.
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeO}=\dfrac{0,1.72}{0,1.72+0,3.80}.100\%\approx23,08\%\\\%m_{CuO}\approx76,92\%\end{matrix}\right.\)
b, Để thu được VH2 tối đa thì mFe (trong K) phải tối đa.
Ta có: \(\left\{{}\begin{matrix}n_{CO\left(dư\right)}+n_{CO_2}=0,25\\28n_{CO\left(dư\right)}+44n_{CO_2}=10,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{CO_{\left(dư\right)}}=0,05\left(mol\right)\\n_{CO_2}=0,2\left(mol\right)\end{matrix}\right.\)
⇒ nFe max = nFeO = nO (trong FeO) = nCO2 = 0,2 (mol)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(\Rightarrow n_{H_2\left(max\right)}=n_{Fe\left(max\right)}=0,2\left(mol\right)\Rightarrow V_{H_2\left(max\right)}=0,2.22,4=4,48\left(l\right)\)

1)Khí sau phản ứng gồm :
CO : a(mol)
CO2:b(mol)
Bảo toàn nguyên tố với C: a + b = \(\dfrac{6,72}{22,4} = 0,3(mol)\)(1)
\(M_{khí} = 20.2 = 40(đvC)\)
Ta có : 28a + 44b = (a + b).40(2)
Từ (1)(2) suy ra : a = 0,075; b = 0,225
\(CO + O_{oxit} \to CO_2\\ n_{O(oxit)} = n_{CO_2} = 0,225(mol)\\ m_{Fe} + m_O = m_{oxit}\\ \Rightarrow n_{Fe} = \dfrac{13,05-0,225.16}{56}=0,16875(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{n_O} = \dfrac{0,16875}{0,225} = \dfrac{3}{4}\)
Vậy oxit cần tìm : Fe3O4
2) \(\%V_{CO_2} = \dfrac{0,225}{0,225+0,075}.100\% = 75\%\)

a) \(CuO+CO\underrightarrow{t^o}Cu+CO2\)
\(FexOy+yCO\underrightarrow{t^o}xFe+yCO2\)
\(Fe+2HCl\rightarrow FeCl2+H2\)
Ta có:
\(n_{H2}=\dfrac{4,704}{22,4}=0,21\left(mol\right)\)
\(\Rightarrow n_{Fe}=0,21\left(mol\right)\Rightarrow m_{Fe}=11,76\left(g\right)\)
\(\Rightarrow m_{Cu}=14,32-11,76=2,56\left(g\right)\)
\(\Rightarrow n_{Cu}=\dfrac{2,56}{64}=0,04\left(mol\right)\)
\(\Rightarrow n_{CuO}=0,04\left(mol\right)\)
\(\Rightarrow\%m_{CuO}=\dfrac{0,04.80}{19,44}.100\%=16,46\%\)
\(\Rightarrow\%m_{FexOy}=100-16,46=83,54\%\)
b) \(m_{FexOy}=19,44-0,04.80=16,24\left(g\right)\)
\(n_{Fe}=0,21\left(mol\right)\)
\(\Rightarrow n_{FexOy}=\dfrac{1}{x}n_{Fe}=\dfrac{0,21}{x}\left(mol\right)\)
\(M_{FexOy}=\dfrac{16,24}{\dfrac{0,21}{x}}=\dfrac{232}{3}x\)
| x | 1 | 2 | 3 |
| \(M_{FexOy}\) | 77,33(loại) | 154,6(loại) | 232(TM) |
\(\Rightarrow FexOy\) là \(Fe3O4\)
Chúc bạn học tốt ^^
Câu a tính khối lượng mỗi chất trong hh ban đầu phải không ạ?

2yAl +3FexOy -to-> 3xFe + yAl2O3 (1)
phần 1 : Fe +4HNO3 --> Fe(NO3)3 + NO +2H2O (2)
Al2O3 + 6HNO3 --> 2Al(NO3)3 +3H2O (3)
Al +4HNO3 --> Al(NO3)3 +NO +2H2O (4)
P2 : Al2O3 +2NaOH --> 2NaAlO2 +H2O (5)
2Al +2H2O +2NaOH --> 2NaAlO2 +3H2 (6)
vì khi cho phần 2 td vs NaOH dư thấy giải phóng H2 => Al dư sau (1)
nH2=0,015(mol)
nFe(P2)=0,045(mol)
giả sử P1 gấp k lần P2
=> nFe(P1)=0,045k(mol)
theo (5) : nAl(P2)=2/3nH2=0,01(mol)
=>nAl(P1)=0,01k(mol)
nNO=0,165(mol)
theo (2,4) :nNO=(0,045k+0,01k) (mol)
=>0,055k=0,165=> k=3
=>nAl(P1)=0,03(mol)
nFe(p1)=0,135(mol)
\(\Sigma nFe=0,045+0,135=0,18\left(mol\right)\)
\(\Sigma nAl=0,03+0,01=0,04\left(mol\right)\)
mAl2O3=\(14,49-0,135.56-0,03.27=6,12\left(g\right)\)
nAl2O3(P1)=0,06(mol)
=> nAl2O3(P2)=0,02(mol)
\(\Sigma nAl2O3=0,08\left(mol\right)\)
theo (1) : nFe=3x/ynAl2O3
=> 0,18=3x/y.0,08=> x/y=3/4
=>CTHH : Fe3O4
theo (1) :nFe3O4 =1/3nFe=0,06(mol)
=>m=0,04.27+0,06.232=15(g)
bạn Lê Đình Thái ơi bạn giải nhầm tìm m rồi. Cái 0,04 mol đó là mol dư, bạn phải cộng với 0,16 mol phản ứng khi xảy ra phản ứng nhiệt phân nữa.
Kết quả là m=0,2.27+0,06.232=19,32 gam

Đáp số a/ Fe2O3
fexoy + 2yhcl-->2fecly + yh2o
có số mol 8/(56 nhân x + 16 nhân y)= 0,3/2y
x=2 y=3
fe2o3 + 3co -->fe + 3co2
0,05 0,15
ta có co co2 28 44 34 10 6