Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt a, b, c là số mol Al203, CuO , FeO mA = 102a + 80b + 72c = 20,3 m rắn = 102a + 64b + 56c = 17,1 nHCl = 6a + 2b + 2c = 0,7 -> a = 0,05 ; b = c = 0,1 Trong B chứa nCO2 = b + c = 0,2 nCaCO3 = 0,1 -> nCa(HCO3)2 = 0,05 -> nCa(OH)2 = 0,15 -> Vdd =105 ml

nCO2=4,4822,44,4822,4=0,2mol
MgCO3+ H2SO4 <=> MgSO4 + CO2 + H2O (1)
RCO3 + H2SO4 <=>RSO4 + CO2 +H2O (2)
Theo (1) và (2)=>nMgCO3 +nRCO3=nH2SO4=nCO2=0,2 mol
Khi nung chất rắn B còn khí CO2 thoát ra nên chứng tỏ muối cacbonat còn dư nên xảy ra 1 hoặc 2 phản ứng sau
MgCO3\to\limits^{t^o}\to\limits^{t^o}MgO + CO2 (3)
RCO3\to\limits^{t^o}\to\limits^{t^o} RO + CO2 (4)
Muối cacbonat dư nên H2SO4 hết
CMH2SO4=0,20,50,20,5=0,4M
*Theo (1) và (2) cứ 1 mol muối cacbonat chuyển thành 1 mol muối sunfat(=CO3 =SO4)
Khối lượng tăng:96-60=36g
mà có 0,2 mol muối cacbonat chuyển thành 2 mol muối sunfat nên khối lượng tăng
36.0,2=72
Theo định luật bảo toàn khối lượng có
khối lượng chất rắn B + muối(ddA)=115,3+72
=> khối lượng chất rắn B=115,3+7,2- muối khan A
mB=112,5-12=110,5
từ (3) và (4) => khối lượng C=mB -mCO2
mà nCO2=11,222,411,222,4=0,5mol
=> mCO2=0,5.44=22g
nên mC=110,5-22=88,5g
*Theo (1),(2),(3),(4),ta thấy
nMgCO3 +mRCO3=nCO2=0,2+0,5=0,7
Gọi x là số mol MgCO3 thì số mol RCO3 là 2,5x
x + 2,5x=0,7
=> 3,5x=0,7
=> x= 0,2mol
=> nMgCO3=0,2 mol
và nRCO3=0,2.2,5=0,5mol
mà mMgCO3 + mRCO3=115,3
mMgCO3=84
nên ta có 0,2.84 + 0,5(R + 60)=115,3
=> R=137 đó là kim loại Bari
a./ Các phản ứng xảy ra:
Cho hh 2 muối tác dụng với H2SO4 loãng
MgCO3 + H2SO4 → MgSO4 + H2O + CO2
RCO3 + H2SO4 → RSO4 + H2O + CO2
Số mol khí CO2 sinh ra: n(CO2 1) = 4,48/22,4 = 0,2mol
Nung chất rắn không tan sau pư thấy thoát ra khí CO2 → muối cacbonat dư → H2SO4 đã tham gia phản ứng hết.
Số mol H2SO4 đã dùng: n(H2SO4) = n(CO2) = 0,2mol
Nồng độ dung dịch H2SO4: C(H2SO4) = 0,2/0,5 = 0,4M
b./ Theo ĐL bảo toàn khối lượng:
m(hh muối) + m(H2SO4) = m(muối khan) + m(B) + m(CO2) + m(H2O)
→ m(B) = m(hh muối) + m(H2SO4) - m(muối khan) - m(CO2) - m(H2O) = 115,3 + 0,2.98 - 12.2 - 0,2.44 - 0,2.18 = 110,3g
c./ Số mol CO2 thu được khi nung B: n(CO2 2) = 11,2/22,4 = 0,5mol
Tổng số mol hai muối:
n(hh muối) = n(MgCO3) + n(RCO3) = n(CO2 1) + n(CO2 2) = 0,2 + 0,5 = 0,7mol
n(RCO3) = 2,5.n(MgCO3) → n(MgCO3) = 0,2mol và n(RCO3) = 0,5mol
Khối lượng mỗi muối:
m(MgCO3) = 84.0,2 = 16,8g
m(RCO3) = m(hh muối) - m(MgCO3) = 115,3 - 16,8 = 98,5g
Khối lượng mol phân tử của muối cacbonat cần tìm:
M(RCO3) = R + 60 = m(RCO3)/n(RCO3) = 98,5/0,5 = 197
→ R = 137
Vậy kim loại cần tìm là Ba.




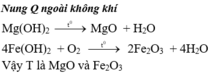
H2 + CuO →Cu + H2O (1)
CO + CuO→ Cu + CO2(2)
CO2 + Ca(OH)2→ CaCO3 + H2O
nCaCO3 = nCO2 = 2:100=0,02 mol =nCu(1)=nCO
⇒mCO = 0,02 . 28=0,56g
\(\Sigma\)nCu = 1,92: 64=0,03 mol ⇒nCu(2) = 0,03-0,02=0,01mol=nH2
⇒mH2 = 0,01 . 2 = 0,02g ⇒%mH2=3,4% %mCO=96,6%
VCO2= 0,02 . 22,4=0,448 l