Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Crackinh V lít C4H10 → hhX gồm 5 hiđrocacbon.
3X + 1H2 → hhY. Dẫn Y qua xt Ni/to
→ hhZ gồm 4 hiđrocacbon có V giảm 25% so với Y.
Z không có khả năng làm mất màu dd Br2 → Z là hh ankan và H2 dư.
• Giả sử có 3 mol X + 1 mol H2.
Vì hhZ gồm 4 hiđrocacbon và có thể tích giảm 25% so với ban đầu
→ nH2phản ứng = 4 x 25% = 1 mol → nanken = 1 mol.
→ Trong hhY có nankan = nC4H10 dư + nCH4 + nCH3-CH3
= nC4H10 ban đầu = 2 mol
H = 1 2 = 50 %

nH+=0,4+0,1.a
nNO3-=0,1a
bạn viết phương trình Mg+H+ +NO3- dưới dạng pt ion
H++NO3 ttuowng đương với HNO3 loãng
rồi bạn sử dụng phương pháp đường chéo, định luật bảo toàn nguyên tố và electron

104,48gam104,48gam
Giải thích các bước giải:
Sơ đồ phản ứng:
⎧⎪ ⎪ ⎪⎨⎪ ⎪ ⎪⎩AlMgFeOFe3O4+HNO3−−−−−→⎧⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎨⎪ ⎪ ⎪ ⎪ ⎪ ⎪⎩NO,N2OH2O⎧⎪⎨⎪⎩Al(NO3)2Mg(NO3)2Fe(NO3)2to→⎧⎨⎩Al2O3MgOFe2O3+NO2+O2{AlMgFeOFe3O4→+HNO3{NO,N2OH2O{Al(NO3)2Mg(NO3)2Fe(NO3)2→to{Al2O3MgOFe2O3+NO2+O2
Oxi chiếm 20,22%20,22% khối lượng hỗn hợp.
mO=25,32%.25,32=5,12gammO=25,32%.25,32=5,12gam
→nO=0,32mol→nO=0,32mol
Gọi số mol của NONO và N2ON2O lần lượt là xx và yy mol
⎧⎨⎩x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02{x+y=3,58422,4=0,16mol30x+44y=0,16.2.15,875→{x=0,14y=0,02
Quy đổi hỗn hợp X thành các nguyên tố: Al,Mg,Fe,OAl,Mg,Fe,O
→mKl=25,32−5,12=20,2g→mKl=25,32−5,12=20,2g
→mO(cr)=30,92−20,2=10,72gam→mO(cr)=30,92−20,2=10,72gam
→nO=0,67mol→nO=0,67mol
3nAl+3nFe+2nMg=2nO(cr)3nAl+3nFe+2nMg=2nO(cr)
Gọi số mol của NH4NO3NH4NO3 là xx mol
Bảo toàn e:
3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O3nAl+3nFe+2nMg=2nO+8nNH4NO3+3nNO+8nN2O
0,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.80,67.2=2.0,32+8nNH4NO3+3.0,14+0,02.8
→nNH4NO3=0,015mol→nNH4NO3=0,015mol
Khối lượng muối:
m=mKl+mNO−3+mNH4NO3m=mKl+mNO3−+mNH4NO3
=20,2+0,67.2.62+0,015.80=104,48gam
Bài này cũng cho số liệu dạng tương đối vì thế ta có thể tự chọn lượng chất để giải. Khi crakinh butan ta có các phản ứng xảy ra:
Do đó hỗn hợp X gồm 5 hidrocacbon là CH4, C3H6, C2H4, C2H6 và C4H10 dư. Khi cho hỗn hợp Y qua xúc tác Ni Nung nóng:
Vì các phản ứng xảy ra hoàn toàn và hỗn hợp khí Z thu được sau phản ứng không có khả năng làm nhạt màu dung dịch brom nên trong Z không còn các anken. Do đó các anken đã phản ứng hết.
Chọn 4 mol hỗn hợp Y thì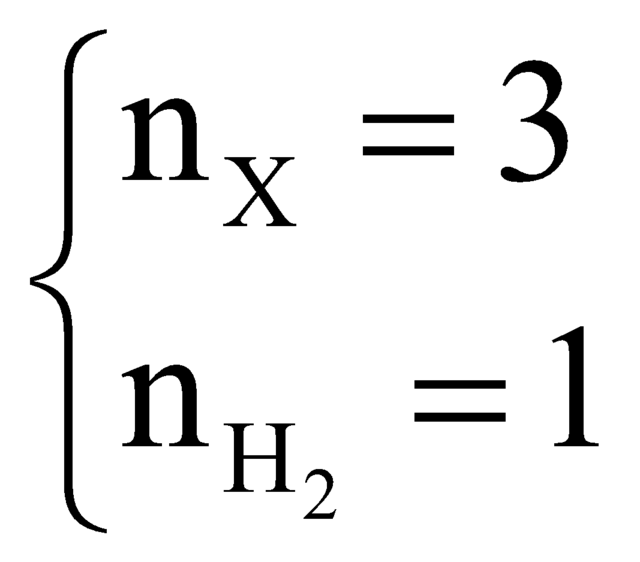
Vì hỗn hợp Z có thể tích giảm 25% so với Y nên tổng thể tích khí trong Z là 3.
Có nanken =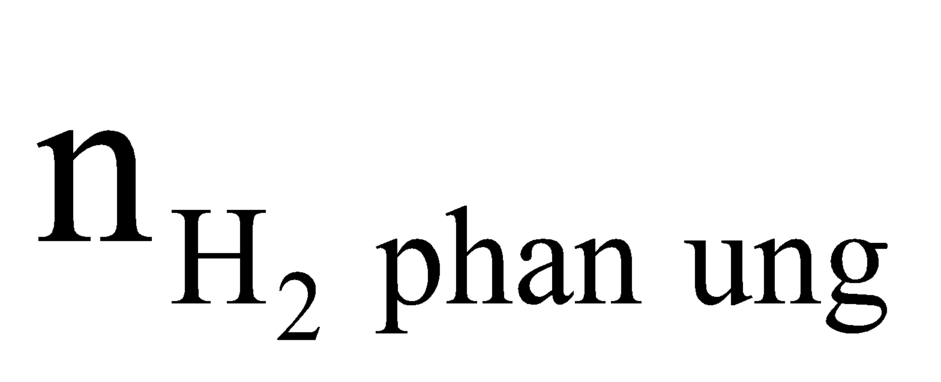 = nkhí giảm = nY - nZ = 1(mol)
= nkhí giảm = nY - nZ = 1(mol)
Do đó trong hỗn hợp X có 1 mol anken và 2 mol ankan.
Mà khi crakinh thì nankan mới = nanken
Vậy H = 1/ 2.100% = 50%
Đáp án A.