Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo gt ta có: $n_{CO_2/(1)}=0,1(mol);n_{CO_2/(2)}=0,15(mol)$
Gọi số mol HCl và Na2CO3 lần lượt là a;b(mol)
$Na_2CO_3+2HCl\rightarrow 2NaCl+CO_2+H_2O$
$Na_2CO_3+HCl\rightarrow NaHCO_3+NaCl$
$NaHCO_3+HCl\rightarrow NaCl+H_2O+CO_2$
Dựa vào 3 phản ứng ta nhận xét là thí nghiệm nào cho lượng CO2 ít hơn chính là nhỏ từ từ HCl và Na2CO3
Do đó ta có:
+, Trường hợp 1: $\frac{a}{2}=0,1;a-b=0,15$
Giải hệ ta được $a=0,2;b=0,05$ (vô lý)
+, Trường hợp 2: $b=0,1;a-b=0,15$
Giải hệ ta được $a=0,25;b=0,1$ (Thỏa mãn)

a) 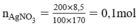
Phương trình hóa học của phản ứng:
HCl + AgNO3 → AgCl + HNO3
Theo pt nHCl = nAgCl = 0,1 mol
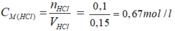
b) 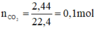
Phương trình hóa học của phản ứng:
HCl + NaHCO3 → NaCl + CO2↑ + H2O
Theo pt: nHCl = nCO2 = 0,1 mol ⇒ mHCl = 0,1. 36,5 = 3,65 g
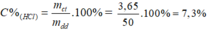

Đáp án B
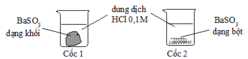
Sử dụng yếu tố diện tích tiếp xúc, TN2 BaSO3 dạng bột sẽ làm tăng diện tích tiếp xúc, tốc độ phản ứng xảy ra nhanh hơn.

Chọn đáp án C
Chú ý : Vì ở cốc 2 có Zn phản ứng với Cu2+ nên V1 >V2
Tuy nhiên các bạn cũng chú ý là ở cốc 2 có ăn mòn điện hóa nên tốc độ nhanh hơn

Chọn B
Khi tăng nồng độ chất phản ứng tốc độ phản ứng tăng
→ Cốc A xuất hiện kết tủa nhanh hơn cốc B

\(n_{HCl}=0,3\cdot0,5=0,15mol\\ n_{CO_2}=\dfrac{1,12}{22,4}=0,05mol\\ n_{CaCO_3}=\dfrac{20}{100}=0,2mol\\ n_{Na_2CO_3}=x;n_{NaHCO_3}=y\\ 0,15=x+0,05\\ x=0,1\\ BTNT:\\ 0,2+0,05=x+y\\ y=0,25-0,1=0,15\\ a=0,1\cdot106+0,15\cdot84=23,2g\)
\(n_{HCl}=0,3.0,5=0,15\left(mol\right)\\ n_{CO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ n_{CaCO_3}=\dfrac{20}{100}=0,2\left(mol\right)\)
Phản ứng xảy ra theo thứ tự:
\(HCl+Na_2CO_3\rightarrow NaHCO_3+NaCl\) (1)
0,1--->0,1--------->0,1
\(HCl+NaHCO_3\rightarrow NaCl+H_2O+CO_2\) (2)
0,05<--0,05<-----------------------------0,05
Vì X + \(Ca\left(OH\right)_2\) dư tạo kết tủa => \(NaHCO_3\) dư, \(HCl\) hết.
\(Ca\left(OH\right)_2+2NaHCO_3\rightarrow CaCO_3\downarrow+Na_2CO_3+2H_2O\)
0,4<--------0,2
\(a=m_{Na_2CO_3}+m_{NaHCO_3}=106.0,1+84\left(0,05+0,4-0,1\right)=40\left(g\right)\)

Đáp án B
Dùng bột kẽm làm tăng diện tích tiếp xúc của kẽm với axit, làm tăng tốc độ phản ứng

Các yếu tố ảnh hưởng đến tốc độ phản ứng là: nồng độ (càng cao tốc độ càng tăng), nhiệt độ (càng cao tốc độ càng tăng), diện tích tiếp xúc (càng cao tốc độ càng tăng), áp suất (với chất khí càng cao tốc độ càng tăng), xúc tác (luôn tăng)
Ta thấy ở thí nghiệm 2 nồng độ HCl, nhiệt độ, áp suất, xúc tác là như nhau. Diện tích tiếp xúc ở nhóm 2 nhiều hơn nhóm 1 (do bột nhỏ hơn miếng) nên nhóm 2 khí thoát ra mạnh hơn. Đáp án A.

Đáp án B
Dùng bột kẽm làm tăng diện tích tiếp xúc của kẽm với axit, làm tăng tốc độ phản ứng.