
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu trả lời đúng là C.
PT: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Từ phản ứng này ⇒ có thể điều chế khí H2
Khí H2 nhẹ hơn không khí nên úp ngược ống nghiệm sẽ thu được khí H2

b1: viết pthh
cl2+ h2-> 2hcl
b2: tính số mol cá chất dựa vào khối lượng hoăc thể tích đề bài cho
nH2= 67,2/224=3 mol
b3: dựa vào phương trình tính số mol các chất còn lại
theo pthh: ncl2=nh2=3 mol
nhcl=2nh2=3*2=6 mol
b4: tính khối lượng hoặc thể tích chất đề bài yêu cầu
=> Vcl2= 3*22,4=67,2l
mhcl=6* 36,5= 219g
CHÚC BẠN HỌC TỐT!

Có: nH2= 67,2:22,4=3(mol)
PTPƯ: H2 + Cl2 --to--> 2 HCl
(mol) 1 1 2
(mol) 3 3 6
(l) 67,2 67,2 134,4
(g) 6 213 219

Fe + 2HCl → FeCl2 + H2
Zn + 2HCl → ZnCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
a) Đặt khối lượng của ba kim loại là 1 gam
→ nFe = 1/56 mol, nZn = 1/65 mol, nAl = 1/27 mol
→ Số mol H2 do sắt tạo thành: nH2 (1) = 1/56 mol
Số mol H2 do kẽm tạo thành: nH2 (2) = 1/65 mol
Số mol H2 do nhôm tạo thành: nH2 (3) = 1/18 mol
→ Số mol H2 (2) < (1) < (3)
→ Nếu lấy cùng khối lượng mỗi kim loại trên thì nhôm có thể tạo ra nhiều khí nhất.
b) Đặt số mol khí H2 tạo thành là 1 mol
→ nFe = 1 mol → m Fe = 56 gam
nZn = 1 mol → mZn = 65 gam
nAl = 2/3 mol → mAl = 18 gam
→ Để tạo thành được 1 mol khí H2 thì dùng Al sẽ tốn ít kim loại nhất

`4H_2 + Fe_3 O_4` $\xrightarrow{t^o}$ `3Fe + 4H_2 O`
`n_{Fe} = (33,6)/56 = 0,6 (mol)`
`a.`
Theo phương trình: `n_{Fe_3 O_4} = 1/3n_{Fe} = 0,2 (mol)`
`-> m_{Fe_3 O_4} = 0,2 . 232 = 46,4 (g)`
`b.`
Theo phương trình: `n_{H_2} = 4/3n_{Fe} = 0,8 (mol)`
`-> V_{H_2} = 0,8 . 22,4 = 17,92 (l)`
`c.`
`2H_2 O` $\xrightarrow{\text{điện phân}}$ `2H_2 + O_2`
Theo phương trình: `n_{H_2 O} = H_2 = 0,8 (mol)`
`-> m_{H_2 O} = 0,8 . 18 = 14,4 (g)`
a) Khối lượng Fe3O4 cần dùng để điều chế 33,6 g Fe:
232 x 0,2 = 46,4 (g)
b) Thể tích khí cần dùng: 0,8 x 22,4 =17,92 (lít).

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\\
2H_2+O_2\xrightarrow[]{t^o}2H_2O\)
Theo PTHH: \(n_{KMnO_4}=2n_{O_2}=2.\dfrac{1}{2}n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,2.158=31,6\left(g\right)\)

1. Tính khối lượng chất tham gia và sản phẩm
* Các bước giải:
- Đổi số liệu đầu bài. Tính số mol của chất mà đầu bài cho.
- Lập phương trình hoá học.
- Dựa vào số mol chất đã biết để tính số mol chất cần tìm.
2. Tính thể tích khí tham gia và tạo thành
H2+Cl2->2HCl
\(n_{H_2}=67,2:22,4=3\left(mol\right)\)
Ta có: \(n_{H_2}=n_{Cl_2}=3\left(mol\right)\)
\(V_{Cl_2}=3.22,4=67,2l\)
\(n_{HCl}=2n_{Cl_2}=2.3=6\left(mol\right)\)
\(m_{HCl}=6.36,5=219g\)

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
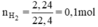
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.
Trong phòng thí nghiệm :
\(Chất\ rắn :Al,Mg,Zn,Fe,...\\ Dung\ dịch : HCl,H_2SO_4\ loãng,...\\ Mg+ 2HCl \to MgCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\)
Trong công nghiệp :
\(2H_2O \xrightarrow{đp} 2H_2 + O_2\)
– Trong phòng thí nghiệm, người ta điều chế khí hidro bằng cách cho axit (HCl, H2SO4 loãng,…) tác dụng với kim loại (Zn, Fe, Al,…).
phuong-phap-dieu-che-khi-hidro-trong-phong-thi-nghiem
Một số ứng điều chế khí H2 trong phòng thí nghiệm:
Zn + 2HCl → ZnCl2 + H2
Fe + 2HCl → FeCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Fe + H2SO4 → FeSO4 + H2
2. Điều chế khí hidro trong công nghiệpTrong công nghiệp, những phương pháp điều chế khí hidro là:
Điện phân nướcDùng than khử oxi của H2O trong lò khí thanĐiều chế từ khí tự nhiên, khí dầu mỏĐiều chế khí hidro từ điện phân nước
phuong-phap-dieu-che-khi-hidro-trong-phong-cong-nghiep
3. Phản ứng thế là gì?Định nghĩa: Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất.
Ví dụ:
Zn + H2SO4 → ZnSO4 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
Bài tập về điều chế khí Hiđro và phản ứng thếCâu 1. Những PTHH nào dùng để điều chế khí hidro trong PTN?
a) Zn + H2SO4 → ZnSO4 + H2
b) 2H2O(điện phân)→ 2H2 + O2
c) 2Al + 6HCl → 2AlCl3 + 3H2
Trả lời:
PTHH dùng để điều chế khí H2 trong PTN là (a) và (c)PTHH dùng để điều chế khí H2 trong công nghiệp là: (b)Câu 2. Lập PTHH của các sơ đồ phản ứng sau và cho biết chúng thuộc loại PƯHH nào?
a) Mg + O2 —> MgO
b) KMnO4 —> K2MnO4 + MnO2 + O2
c) Fe + CuCl2 —> FeCl2 + Cu
Trả lời:
a) 2Mg + O2 → 2MgO ⇒ Phản ứng hóa hợp, phản ứng oxi hóa khử.
b) 2KMnO4 → K2MnO4 + MnO2 + O2⇒ Phản ứng phân hủy.
c) Fe + CuCl2 → FeCl2 + Cu ⇒ Phản ứng thế.
Câu 3. Khi thu khí O2 vào ống nghiệm bằng cách đẩy không khí, phải để ống nghiệm như thế nào? Đối với khí hidro có làm thế được không? Tại sao?
Trả lời:
Để thu khí O2 vào ống nghiệm bằng cách đẩy không khí, người ta thường để ống nghiệm đứng vì khí O2 nặng hơn không khí. Với khí H2, người ta thu nó bằng cách để úp ống nghiệm để đẩy không khí vì khí H2 nhẹ hơn không khí.
Câu 4. Trong PTN có các kim loại Zn, Fe, dd axit HCl và dung dịch axit H2SO4 loãng:
a) Viết các PTHH có thể điều chế H2.
b) Phải dùng bao nhiêu gam Zn, Fe để điều chế được 2,24 lít khí H2 (đktc).
Trả lời:
a) Các PTHH có thể điều chế H2:
Zn + 2HCl → ZnCl2 + H2 (1)
Zn + H2SO4 → ZnSO4 + H2 (2)
Fe + 2HCl → FeCl2 + H2 (3)
Fe + H2SO4 → FeSO4 + H2 (4)
b) Theo đề bài, ta có:
– Số mol khí H2 là:
nH2 = V/22,4 = 2,24/22,4 = 0,1 (mol)
– Theo các PTHH, ta thấy: nH2 = nZn = nFe = 0,1 (mol)
Số gam Zn cần dùng ở thí nghiệm (1) và (2) là:mZn =0,1 x 65 = 6,5 (gam)
Số gam Fe cần dùng ở thí nghiệm (3) và (4) là:mFe =0,1 x 56 = 5,6 (gam)
Câu 5. Cho 22,4 gam Fe tác dụng với dd loãng có chứa 24,5 gam axit sunfuric H2SO4.
a) Chất nào còn dư sau phản ứng và dư bao nhiêu gam?
b) Tính thể tích khí H2 thu được (đktc).
Trả lời:
a) Ta có PTHH của phản ứng:
Fe + H2SO4 → FeSO4 + H2
– Số mol Fe và H2SO4 là:
nFe = 22,4/56 = 0,4 (mol)
nH2SO4 = 24,5/98 = 0,25 (mol)
– Theo phương trình hóa học:
Cứ 1 mol H2SO4tham gia phản ứng với 1 mol FeVậy 0,25 mol H2SO4tham gia phản ứng với 0,25 mol Fe⇒ nFe (dư) = 0,4 – 0,25 = 0,15 (mol)
⇒ mFe (dư) =0,15 x 56 = 8,4 (gam)
b) Theo PTHH, ta có:
nH2 = nH2SO4 = 0,25 (mol)
Thể tích khí H2 thu được (đktc) là:
VH2 = nH2 x 22,4 = 0,25 x 22,4 = 5,6 (lít)
Lời kết
Vậy là chúng ta vừa tìm hiểu xong cách điều chế khí hidro trong phòng thí nghiệm và trong công nghiệp. Bên cạnh đó là khái niệm về phản ứng thế. Chúc các bạn luôn học tốt và đam mê hóa học nhé!
Đánh giá bài viết