
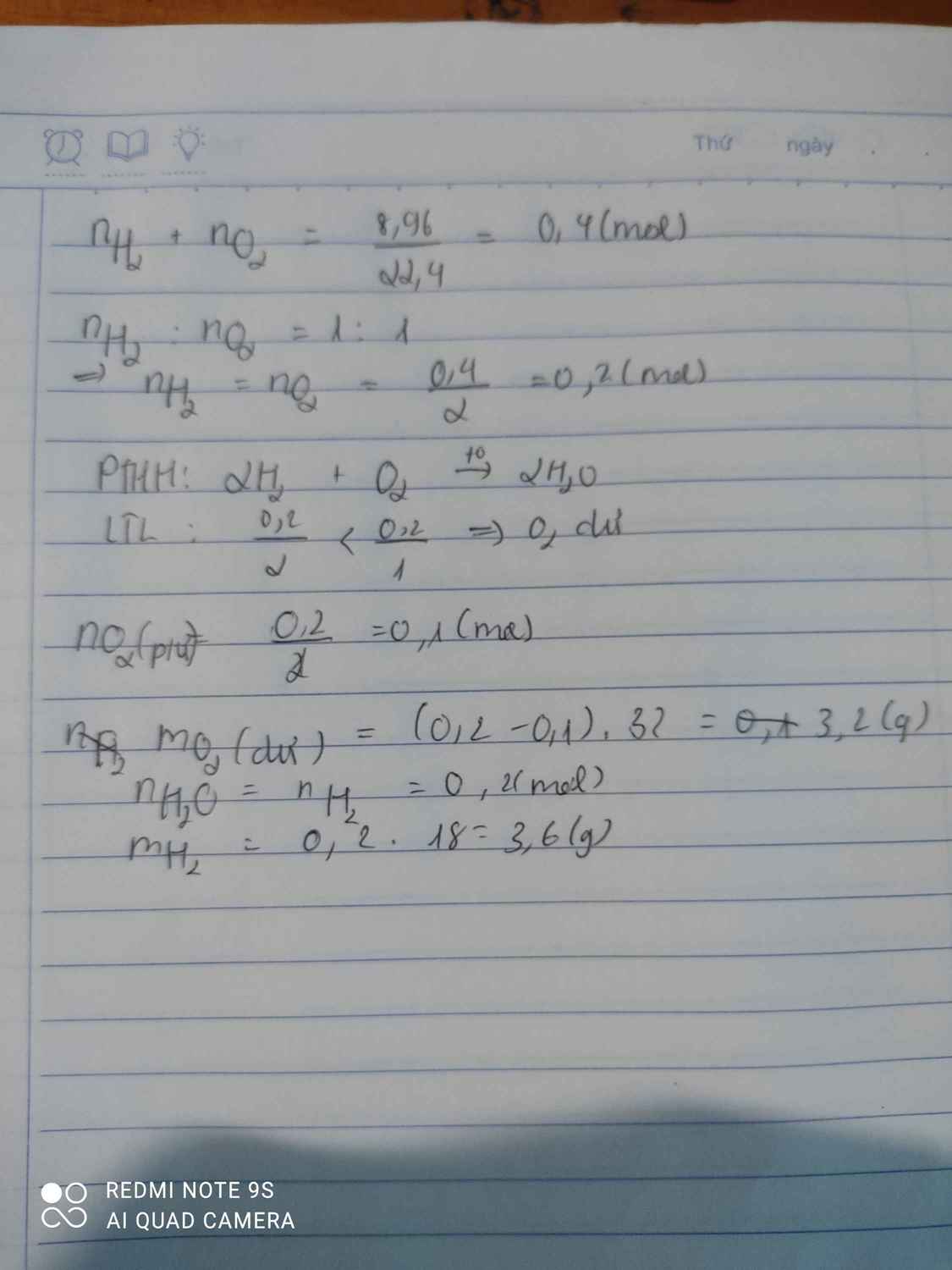
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

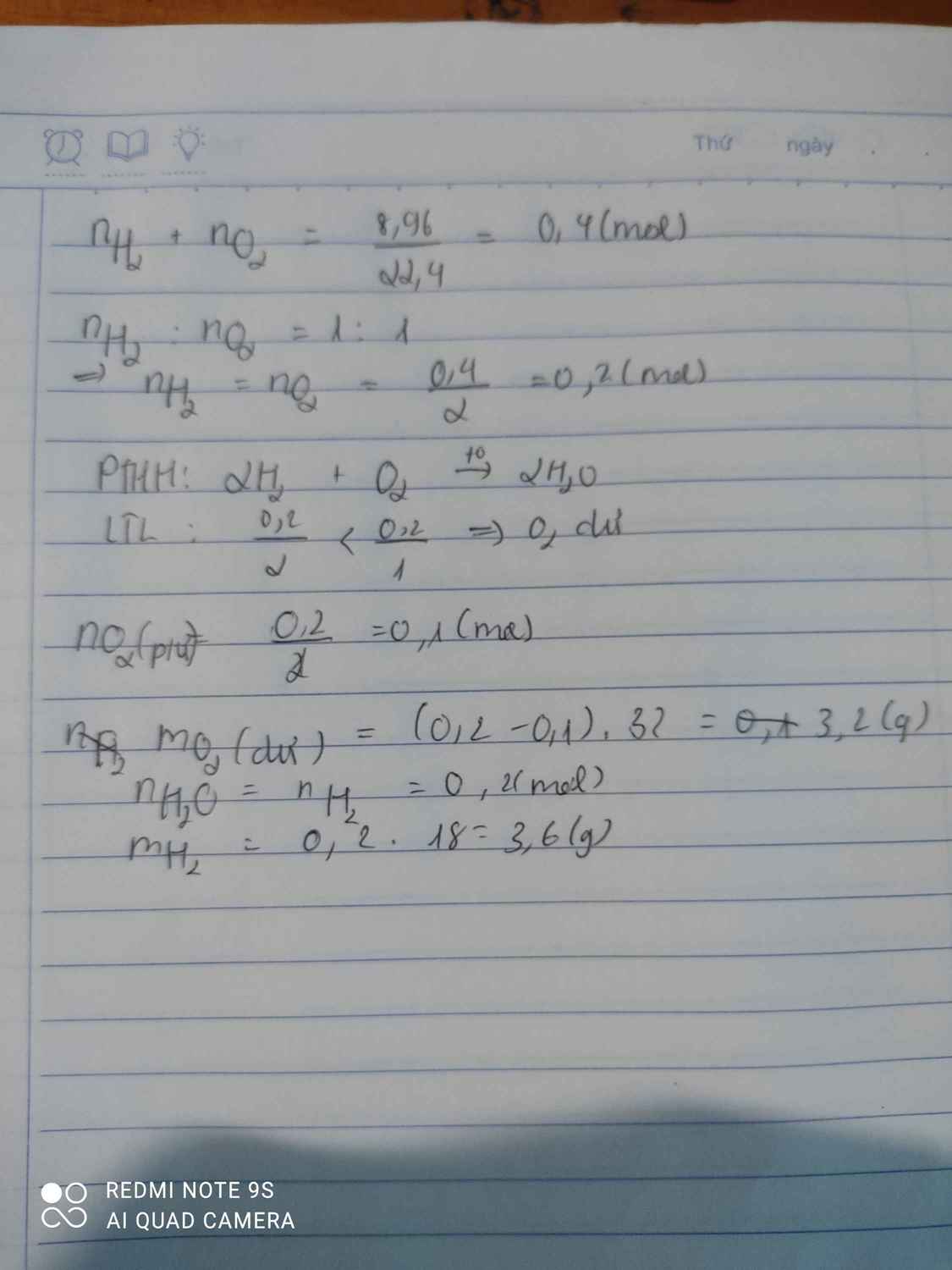

Gọi a (mol) và b (mol) lần lượt là số mol khí H2 và khí O2 ban đầu.
Phân tử khối trung bình của hỗn hợp khí thu được sau phản ứng là 14.2=28 (g/mol), hỗn hợp gồm H2O (a mol) và O2 (b-a/2 mol).
18a+32(b-a/2)=(a+b-a/2).28 \(\Rightarrow\) b=3a.
Thành phần phần trăm các khí trong hỗn hợp ban đầu:
%Vkhí hiđro=\(\dfrac{a}{a+b}\).100%=\(\dfrac{a}{5a}\).100%=20%, suy ra %Vkhí oxi=100%-20%=80%.
Xin lỗi! Mình làm sai rồi.
Chữa:
Gọi a (mol) và b (mol) lần lượt là số mol khí H2 và khí O2 ban đầu.
Phân tử khối trung bình của hỗn hợp khí thu được sau phản ứng là 14.2=28 (g/mol), hỗn hợp gồm H2O (a mol) và O2 (b-a/2 mol).
18a+32(b-a/2)=(a+b-a/2).28 ⇒ b=3a.
Thành phần phần trăm các khí trong hỗn hợp ban đầu:
%Vkhí hiđro=\(\dfrac{a}{a+b}\).100%=\(\dfrac{a}{4a}\).100%=25%, suy ra %Vkhí oxi=100%-25%=75%.

Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol CH4, C2H6 là a, b (mol)
=> \(a+b=\dfrac{25}{1}=25\left(mol\right)\) (1)
\(n_{O_2}=\dfrac{95}{1}=95\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
a---->2a---------->a
2C2H6 + 7O2 --to--> 4CO2 + 6H2O
b------>3,5b-------->2b
=> \(\left\{{}\begin{matrix}n_{O_2\left(dư\right)}=95-2a-3,5b\left(mol\right)\\n_{CO_2}=a+2b\left(mol\right)\end{matrix}\right.\)
=> \(95-a-1,5b=\dfrac{60}{1}=60\)
=> a + 1,5b = 35 (2)
(1)(2) => a = 5; b = 20
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{5}{25}.100\%=20\%\\\%V_{C_2H_6}=\dfrac{20}{25}.100\%=80\%\end{matrix}\right.\)
\(\overline{M}_A=\dfrac{5.16+20.30}{5+20}=27,2\left(g/mol\right)\)
\(\overline{M}_B=20,5.2=41\left(g/mol\right)\)
=> \(d_{A/B}=\dfrac{27,2}{41}\approx0,663\)

a)
\(V_{H_2} = V_{O_2} = \dfrac{4,48}{2} = 2,24(lít)\)
b)
\(2H_2 + O_2 \xrightarrow{t^o} 2H_2O\\ V_{H_2} = 2,24 < 2V_{O_2} = 4,48(lít)\)
Do đó, O2 dư.
\(V_{O_2\ pư} = \dfrac{1}{2}V_{H_2} = 1,12(lít)\\ \Rightarrow V_A = V_{O_2\ dư} = 2,24 - 1,12 = 1,12(lít)\)
a, Theo bài ra ta có : \(\left\{{}\begin{matrix}V_{H2}+V_{O2}=4,48\\V_{H2}=V_{O2}\end{matrix}\right.\)
\(\Rightarrow V_{O2}=V_{H2}=2,24\left(l\right)\)
b, Ta có : \(n_{O_2}=n_{H_2}=\dfrac{V}{22,4}=0,1\left(mol\right)\)
\(PTHH:2H_2+O_2\rightarrow2H_2O\)
Thấy sau phản ứng O2 dư .
=> \(V_A=V_{O2du}=22,4\left(n_{o2}-n_{O2pu}\right)=1,12\left(l\right)\)
Vậy ..

nhh = 8.96/22.4 = 0.4 (mol)
nH2 = nO2 = 0.4/2 = 0.2 (mol)
Đặt : nO2 (pư) = x (mol)
2H2 + O2 -to-> 2H2O
Bđ: 0.2____0.2
Pư: 2x_____x______2x
Kt : 0.2-2x__0.2-2x__2x
M = 10*2 = 20 (g/mol)
=> (0.2-2x)*2 + (0.2-2x)*32 + 2x * 18 = (0.2-2x+0.2-2x+2x)*20
=> x = 0.06
H% = 0.06*2/0.2 * 100% = 60%
\(n_{hh_1}=\dfrac{V_{hh_1}}{22,4}=0,4\left(mol\right)\)
\(\Rightarrow n_{H_2}=n_{O_2}=0,2\left(mol\right)\)
PTHH: \(2H_2+O_2\rightarrow2H_2O\)
.............2............1................2.........
Sản phẩm sau khi nổ gồm \(H_2O\left(n=2x\right);H_2\left(\text{dư};n=0,2-2x\right);O_2\left(\text{dư};n=0,2-x\right)\)
Mà hỗn hợp khí và hơi có tỉ khối so với H2 là 10 nên:
\(d_{\dfrac{hh_2}{H_2}}=\dfrac{M_{hh_2}}{2}=10\\ \Rightarrow M_{hh_2}=20\left(g/mol\right)\)
Ta có pt: \(18\cdot2x+2\left(0,2-2x\right)+32\left(0,2-x\right)=20\left(2x+0,2-2x+0,2-x\right)\)
Giải pt ta được \(x=0,06\)
\(H=\dfrac{2x}{0,2}\cdot100\%=\dfrac{2\cdot0,06}{0,2}\cdot100\%=60\%\)

nhh1=Vhh122,4=0,4(mol)nhh1=Vhh122,4=0,4(mol)
⇒nH2=nO2=0,2(mol)⇒nH2=nO2=0,2(mol)
PTHH: 2H2+O2→2H2O2H2+O2→2H2O
.............2............1................2.........
Sản phẩm sau khi nổ gồm H2O(n=2x);H2(dư;n=0,2−2x);O2(dư;n=0,2−x)H2O(n=2x);H2(dư;n=0,2−2x);O2(dư;n=0,2−x)
Mà hỗn hợp khí và hơi có tỉ khối so với H2 là 10 nên:
dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)dhh2H2=Mhh22=10⇒Mhh2=20(g/mol)
Ta có pt: 18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)18⋅2x+2(0,2−2x)+32(0,2−x)=20(2x+0,2−2x+0,2−x)
Giải pt ta được x=0,06x=0,06
H=2x0,2⋅100%=2⋅0,060,2⋅100%=60%