Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Bài 1
Chọn hệ số và CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi trong các phương trình hóa học sau:
a) ? Na + ? → 2 Na2O
b) ? CuO + ?HCl → CuCl2 + ?
c) Al2(SO4)3 + ? BaCl2 → ? AlCl3 + ?
d) ? Al(OH)3 → Al2O3 + ?
Bài 2
Chọn hệ số và CTHH thích hợp đặt vào những chỗ có dấu chấm hỏi trong các phương trình hóa học sau:
a) ? CaO + ? HCl → CaCl2 + ?
b) ?Al + ? → 2Al2O3
c) FeO + CO → ? + CO2
d) ?Al + ?H2SO4 →Al2(SO4)3 + ?H2
e) BaCl2 + ?AgNO3 →Ba(NO3)2 + ?
f) Ca(OH)2 + ?HCl → ? + 2H2O
g) 3Fe3O4 + ?Al → ?Fe + ?
h) Ca(OH)2 + CO2 → ? + H2O
i) Ca(HCO3)2 → CaCO3 + CO2 + ?
Bài 3
Lập các PTHH sau và cho biết tỉ lệ số nguyên tử / phân tử của chất phản ứng với sản phẩm.
a) CuO + Cu → Cu2O
b) FeO + O2 → Fe2O3
c) Fe + HCl → FeCl2 + H2
d) Na + H2SO4 → Na2SO4 + H2
e) NaOH + CuSO4 → Cu(OH)2 + Na2SO4
f) Na2CO3 + Ca(OH)2 → CaCO3 + NaOH
g) Fe(OH)3 → Fe2O3 + H2O
h) CaO + HNO3 → Ca(NO3)2 + H2O
i) Fe(OH)x + H2SO4 → Fe2(SO4)x + H2O

cho16g một loại oxit sắt hợp chất của sắt và oxi tác dụng hết với khí hiđro thu được 11,2g fe. tìm công thức hóa học của oxit sắt

ĐỀ BÀI
Phần I: Trắc nghiệm khách quan. ( 4 điểm)
Hãy khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước câu trả lời đúng nhất
Cho các hiện tượng:
1. Hòa tan muối ăn vào nước được nước muối.
2. Khi đánh diêm có lửa bắt cháy.
3. Thanh đồng được kéo thành sợi nhỏ để làm dây điện.
4. Thuỷ tinh được đun nóng chảy ở to cao rồi thổi thành bóng đèn, lọ hoa, cốc …
5. Cho 1 mẫu đá vôi vào giấm ăn thấy có bọt khí thoát ra.
Câu 1: Hiện tượng vật lí là
A. 1, 3 và 4 B. 1 và 2
C. 2 và 3 D. 2 và 5
Câu 2: Hiện tượng hóa học là
A. 1, 3 và 4 B. 1 và 2
C. 2 và 3 D. 2 và 5
Câu 3: Phát biểu đúng là
A. Làm muối từ nước biển là sự biến đổi hóa học.
B. Thức ăn bị ôi thiu là sự biến đổi vật lí.
C. Nung đá vôi là sự biến đổi hóa học.
D. Cồn để trong lọ không kín bị bay hơi là sự biến đổi hóa học.
Câu 4: Cho quá trình sau:
Giai đoạn có sự biến đổi hóa học là
A. I B. II C. III D. IV
Câu 5: Phát biểu sai là
A. Trong 1 PƯHH, tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia.
B. Trong 1 PƯHH, số phân tử của các chất được bảo toàn.
C. Trong 1 PƯHH, số nguyên tử của mỗi nguyên tố được bảo toàn.
D. Trong 1 PƯHH có n chất nếu biết khối lượng của (n-1) chất thì tính được khối lượng của chất còn lại.
Câu 6: Lưu huỳnh cháy theo sơ đồ phản ứng sau: Lưu huỳnh + khí oxi → khí sunfurơ. Nếu đã có 48g lưu huỳnh cháy và thu được 96g khí sunfurơ thì khối lượng oxi đã tham gia phản ứng là
A. 40g B. 44g C. 48g D. 52g
Câu 7: Thủy ngân oxit bị phân huỷ theo sơ đồ sau:
Thuỷ ngân oxit → Thuỷ ngân + Oxi. Khi phân huỷ
2,17g thuỷ ngân oxit thu được 0,16g oxi. Khối lượng thuỷ ngân thu được trong thí nghiệm này là
A. 2g B. 2,01g C. 2,02g D. 2,05g
Câu 8: Một cốc đựng dung dịch axit clohidric và 1 viên kẽm được đặt ở đĩa cân A. Trên đĩa cân B đặt các quả
cân sao cho kim cân ở vị trí cân bằng. Bỏ viên kẽm vào cốc axit. Biết rằng có phản ứng:
Kẽm + axit clohidric → Kẽm clorua + khí hidro. Vị trí của kim cân là
A. Kim cân lệch về phía đĩa cân A. B. Kim cân lệch về phía đĩa cân B.
C. Kim cân ở vị trí thăng bằng. D. Kim cân không xác định.
Câu 9: Khí Nitơ và khí Hidro tác dụng với nhau tạo ra Amoniac (NH3). PTHH viết đúng là
A. N + 3H → NH3 B. N2 + H2 → NH3
C. N2 + H2 →2NH3 D. N2 + 3H2 → 2NH3
Câu 10: PTHH cho biết chính xác
A. Số nguyên tử, phân tử của các chất tham gia phản ứng.
B. Tỉ lệ số phân tử (nguyên tử) của các chất trong phản ứng.
C. Khối lượng của các chất phản ứng.
D. Nguyên tố nào tạo ra chất.
Câu 11: Phản ứng giữa Fe2O3 và CO được biểu diễn như sau:
xFe2O3 + yCO → 2Fe + 3CO2.
Các giá trị của x và y cho phương trình cân bằng là
A. x = 1; y = 1 B. x = 2 ; y = 1 C. x = 1 ; y = 3 D. x = 3 ; y = 1
Câu 12: Cho PTHH: 2Cu + O2 → 2CuO. Tỉ lệ giữa số nguyên tử đồng: số phân tử oxi: số phân tử CuO là
A. 1:2:1 B. 2:1:1 C. 2:1:2 D. 2:2:1
Câu 13: Trong phản ứng hóa học, phân tử này biến đổi thành phân tử khác là do
A. Các nguyên tử tác dụng với nhau.
B. Các nguyên tố tác dụng với nhau.
C. Liên kết giữa các nguyên tử không bị thay đổi.
D. liên kết giữa các nguyên tử thay đổi.
Câu 14: Trong một phản ứng hóa học, các chất phản ứng và chất tạo thành phải chứa cùng
A. Số nguyên tử của mỗi nguyên tố. B. Số nguyên tử trong mỗi chất.
C. Số phân tử của mỗi chất. D. Số nguyên tố tạo ra chất.
Câu 15: Có phát biểu: “Trong PƯHH chỉ xảy ra sự thay đổi liên kết giữa các nguyên tử (1), nên tổng khối lượng các chất được bảo toàn (2)’’. Trong đó
A. (1) đúng, (2) sai.
B. cả 2 ý trên đều đúng và ý (1) giải thích cho ý (2).
C. (1) sai, (2) đúng.
D. cả 2 ý trên đều đúng và ý (2) giải thích cho ý (1).
Câu 16: Phương trình hóa học dùng để
A. Biểu diễn PƯHH bằng chữ.
B. Biểu diễn ngắn gọn PƯHH bằng công thức hoá học.
C. Biểu diễn sự biến đổi của từng chất riêng rẽ.
D. Biểu diễn sự biến đổi của các nguyên tử trong phân tử.
Phần 2: Tự luận (6 điểm)
Câu 17. Lập PTHH của các phản ứng sau, cho biết tỉ lệ số nguyên tử, phân tử của các chất trong mỗi phản ứng
a. Mg + HCl → MgCl2 + H2
b. Fe2O3 + CO → Fe + CO2
c. Al + H2SO4 → Al2(SO4)3 + H2
d. Al + Cl2 → AlCl3
Câu 18. Cho 8,4g bột sắt cháy hết trong 3,2g khí oxi (đktc) tạo ra oxit sắt từ (Fe3O4).
a. Viết PTHH của phản ứng và cho biết tỉ lệ số nguyên tử, phân tử của các chất trong phản ứng.
b. Tính khối lượng oxit sắt từ tạo thành.
Câu 19 . Nếu để một thanh sắt ngoài trời thì sau một thời gian khối lượng thanh sắt sẽ nhỏ hơn, lớn hơn hay bằng khối lượng ban đầu? Hãy giải thích.
ĐÁP ÁN VÀ THANG ĐIỂM
Phần I. Trắc nghiệm khách quan. (4 điểm)
Mỗi lựa chọn đúng đạt 0,25 điểm
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A
D
C
D
B
C
B
B
D
B
C
C
D
A
B
B
Phần II. Tự luận (6 điểm)
Câu
Đáp án
Điểm
Câu 1
(3 điểm)
a. Mg + 2HCl → MgCl2 + H2
0,5đ
Số nguyên tử Mg : số phân tử HCl : số phân tử MgCl2 : số phân tử H2 = 1:2:1:1
0,25
b. Fe2O3 + 3CO → 2Fe + 3CO2
0,5đ
Số phân tử Fe2O3 : số phân tử CO : số nguyên tử Fe : số phân tử CO2 = 1:3:2:3
0,25
c. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,5đ
Số nguyên tử Al : số phân tử H2SO4 : số phân tử Al2(SO4)3 : số phân tử H2 = 2:3:1:3
0,25
d. 2Al + 3Cl2 → 2AlCl3.
Số nguyên tử Al : số nguyên tử Cl2 : số phân tử AlCl3 = 2:3:2
0,5đ
0,25
Câu 2



ĐỀ THI GIAO LƯU HỌC SINH GIỎI LỚP 8
Năm học: 2012-2013
Môn: Hóa Học 8
Thời gian làm bài: 120 phút
Đề thi này gồm 01 trang
Câu 1. (2,0 điểm)
1) Chỉ dùng dung dịch H2SO4 loãng hãy nhận biết các chất rắn đựng trong các lọ mất nhãn: MgO, CuO, BaO, Fe2O3.
2) Chọn các chất thích hợp điền vào chỗ trống và hoàn thành các phản ứng hóa học sau:
a) Ba + H2O ......+ ......
b) Fe3O4 + H2SO4(loãng) ...... + ....... + H2O
c) MxOy + HCl ........+ H2O
d) Al + HNO3 .....+ NaOb + ....
Câu 2. (2,0 điểm)
1) Tổng số hạt proton (P), nơtron (N) và electron (E) của một nguyên tử nguyên tố X là 13. Xác định nguyên tố X?
2) Cho 27,4 gam Ba tác dụng với 100 gam dung dịch H2SO4 9,8%.
a) Tính thể tích khí thoát ra (đktc).
b) Tính nồng độ phần trăm của dung dịch sau phản ứng.
Câu 3. (2,25 điểm)
1) Cho m gam CaS tác dụng vừa đủ với m1 gam dung dịch axit HBr 9,72% thu được m2 gam dung dịch muối x% và 672 ml khí H2S (đktc). Tính m, m1, m2, x.
2) Cho V (lít) CO2 (đktc) hấp thụ hoàn toàn vào 400 ml dung dịch Ba(OH)2 1,5M, sau phản ứng thu được 98,5 gam kết tủa. Tính V?
Câu 4. (1,5 điểm)
Cho hỗn hợp khí A gồm CO2 và O2 có tỉ lệ thể tích tương ứng là 5:1.
a) Tính tỉ khối của hỗn hợp khí A đối với không khí.
b) Tính thể tích (đktc) của 10,5 gam khí A.
Câu 5. (2,25 điểm)
1) Nhiệt phân 66,2 gam Pb(NO3)2 thu được 55,4 gam chất rắn. Tính hiệu suất của phản ứng nhiệt phân. Biết rằng Pb(NO3)2 bị nhiệt phân theo phản ứng:
Pb(NO3)2 PbO + NO2 + O2
2) Hòa tan hoàn toàn 11,2 gam Fe vào dung dịch HNO3 dư, thu được dung dịch A và 6,72 lít (đktc) hỗn hợp khí B gồm NO và một khí X với tỉ lệ thể tích là 1:1. Xác định khí X.
(Thí sinh được sử dụng bảng hệ thống tuần hoàn các nguyên tố hóa học)
----------------HẾT-----------------
http://dethi.violet.vn/present/show/entry_id/11865344
Em có thể coi đề ở link này
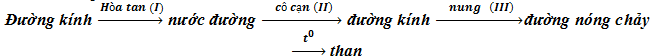



ĐỀ THI CHỌN HỌC SINH GIỎI
MÔN: HÓA HỌC 8
Bài 1: (2,5 điểm)
Viết phương trình hóa học thực hiện chuyển đổi hóa học sau:
S→ SO2→ SO3→ H2SO4 →H2→ Cu
Gọi tên các chất có công thức hóa học như sau: Li2O, Fe(NO3)3, Pb(OH)2, Na2S, Al(OH)3, P2O5, HBr, H2SO4, Fe2(SO4)3, CaO
Bài 2: (1,5 điểm)
Cho 15,68 lít hỗn hợp gồm hai khí CO và CO2 ở đktc có khối lượng là 27,6 gam. Tính thành phần trăm theo khối lượng mỗi khí trong hỗn hợp.
Bài 3: (2 điểm)
Một muối ngậm nước có công thức là CaSO4.nH2O. Biết 19,11 gam mẫu chất có chứa 4 gam nước. Hãy xác định công thức phân tử của muối ngậm nước trên.
Bài 4 (2 điểm)
Cho 32,4 gam kim loại nhôm tác dụng với 21,504 lít khí oxi ở điều kiện tiêu chuẩn.
a/ Chất nào còn dư sau phản ứng? khối lượng chất còn dư là bao nhiêu gam?
b/ Tính khối lượng nhôm oxit tạo thành sau phản ứng.
c/ Cho toàn bộ lượng kim loại nhôm ở trên vào dung dịch axit HCl. Sau khi phản ứng xảy ra hoàn toàn thu được bao nhiêu lít khí H2 ở đktc.
Bài 5 (2 điểm)
Khử hoàn toàn 5,43 gam hỗn hợp CuO và PbO bằng khí hyđro, chất khí thu được dẫn qua bình đựng P2O5 thấy khối lượng bình tăng lên 0,9 gam.
a/ Viết phương trình hóa học.
b/ Tính thành phần phần trăm theo khối lượng của mỗi oxit trong hỗn hợp ban đầu.
Cho biết:Al = 27, O = 16, H = 1, Cu = 64, Pb = 207, Ca = 40, S = 32, C =12
Đáp án đề thi học sinh giỏi môn Hóa học lớp 8
Câu 1:
1/ Viết phương trình hóa học: (1,5 điểm) (Mỗi PTHH được 0,3 điểm)
S + O2→ SO2
2SO2 + O2→ 2SO3
SO3 + H2O → H2SO4
H2SO4 + Zn→ ZnSO4 + H2
H2 + CuO→ Cu + H2O
2/ Gọi tên các chất: (1 điểm) (Mỗi chất gọi tên đúng được 0,1 điểm)
Na2S
Nhôm hyđroxit
Câu 2:
Số mol hỗn hợp: nCO, CO2 = 15,68 /22,4 = 0,7 (0,25 điểm)
Gọi số mol CO và CO2 là x và y (x, y > 0) (0,5 điểm)
Ta có PTĐS: x + y = 0,7 => x = 0,7 – y (1)
28x + 44y = 27,6 (2)
Thay x = 0,7 – y vào (2) giải ra ta được: x = 0,2; y = 0,5 (0,25 điểm)
mCO = 0,2.28 = 5,6 gam; mCO2 = 0,5.44 = 22 gam (0,25 điểm)
%mCO2 = 79,7% ; % mCO = 20,3 % (0,25 điểm)
Câu 3:
Câu 4:
Câu 5:
PTHH: CuO + H2→ Cu + H2O (1) (1 điểm)
PbO + H2→ Pb + H2O (2) (0,5 điểm)
Sau phản ứng chất khí dẫn qua bình đựng P2O2 thấy khối lượng bình giảm 0,9 gam =>mH20 = 0,9 gam => nH20 = 0,9 /18 = 0,05 mol (0,25 điểm)
Gọi số mol CuO và PbO lần lượt là x mol và y mol (x,y > 0) (0,3 điểm)
Ta có PTĐS: 80x + 223y = 5,43 =>
Theo PTHH (1) ta có: nH20 = nCuO= x mol
Theo PTHH (2) ta có: nH2O = nPbO = y mol
x + y = 0,05 => y = 0,05 – x (b) (0,25 điểm)
Thay (b) vào (a) giai ra ta có x = 0,04; y = 0,01 mol
Vậy % theo khối lượng của CuO và PbO là 59%; 40,06% (0,2 điểm)
đề này khá hay khuyên bn nên lm trc khi xem đáp án cách học hữu hiệu nhất á
hóng ^^