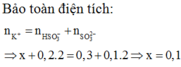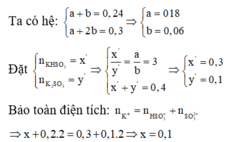Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta thấy : Pư (1) kết tủa tăng dần đến cực đại ; Pư (2) , (3) kết tủa không đổi ; Pư (4) kết tủa tan dần \(\Rightarrow\)Có 2 trường hợp xảy ra .
TH1 : Kết quả thu được là giá trị cực đại
\(\Rightarrow\) Ở cả 2 thí nghiệm : Ba(OH)2 phản ứng hết ; chưa có phản ứng (4)
Ta có : khi xong (1) \(\Rightarrow\) nSO2 = nBa(OH)2 = nBaSO3 = 0,4 mol
Khi xong (1) , (2) , (3) \(\Rightarrow\) nSO2 = 0,4 + 0,7 = 1,1 mol
\(\Rightarrow\) 0,4 \(\le\) nSO2 \(\le\) 1,1
Đặt số mol SO2 trong V lít là x mol \(\Rightarrow\) trong 3,25 V lít là 3,25 x mol
\(\Rightarrow\) 0,4 \(\le\) x \(\le\) 1,1 và 0,4 \(\le\) 3,25x \(\le\) 1,1 ( loại )
TH2 : Kết quả tủa thu chưa đạt cực đại
\(\Rightarrow\) Ở thí nghiệm 1 : Ba(OH)2 dư , SO2 hết , chỉ xảy ra phản ứng (1)
Ở thí nghiệm 2 : Cả Ba(OH)2 và SO2 hết , chỉ xảy ra phản ứng (1) , (2) , (3) xong , (4) xảy ra một phần .
- TN1 : Theo (1) nSO2 = nBaSO3 = 0,4 mol \(\Rightarrow\) V = 8,96 lít
- TN2 : Theo (1) , (2) , (3) \(\Rightarrow\) nSO2 = nBa(OH)2 + nKOH = 0,35a + 0,7
Theo (4) \(\Rightarrow\) nSO2 = nBaSO3 max - nBaSO3 thu được = 0,35a - 0,4
\(\Rightarrow\) ( 0,35a + 0,7 ) - ( 0,35a - 0,4 ) = 0,4.3,25 = 1,3
\(\Rightarrow\) 0,7a = 1 \(\Rightarrow\) a = 10/7 (M)

a,
Nếu Ca(OH)2 dư thì chỉ xảy ra 1 muối CaSO3
SO2+Ca(OH)2 => CaSO3+H2O
n SO2=4,48/22,4=0,2(mol)
n CaSO3=n SO2=0,2(mol)
m CaSO3=0,2.120=24(g)
b, Đổi V=250ml=0,25(l)
=> nCa(OH)2=0,25.0,5=0,125(mol)
n Ca(OH)2<n SO2
=> SO2 hòa tan 1 phần kết tủa
SO2 + Ca(OH)2 => CaSO3+H2O
SO2+CaSO3+H2O => Ca(HSO3)2
Ta có
n SO2=n CaSO3=n Ca(OH)2=0,125(mol)
=>n SO2 dư=0,2-0,125=0,075(mol)
n CaSO3(2)=n SO2=0,075(mol)
=> n CaSO3 còn lại =0,125-0,075=0,05(mol)
m caSO3=0,05.120=6(g)
c, n CaSO3=12/120=0,1(mol)
n CaSO3<n SO2=>SO2 dư
n Ca(OH)2=n CaSO3=0,1(mol)
V=V Ca(OH)2=0,1/0,5=0,2(l)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

Câu 1:
Vì lọc kết tủa, thêm dung dịch Ca(OH)2 vào nước lọc thu được thêm kết tuẩ nên ban đầu tạo ra 2 muối.
\(Ca\left(OH\right)_2+SO_2\rightarrow CaSO_3+H_2O\)
\(Ca\left(OH\right)_2+2SO_2\rightarrow Ca\left(HSO_3\right)_2\)
\(Ca\left(HSO_3\right)_2+Ca\left(OH\right)_2\rightarrow2CaSO_3+2H_2O\)
Ta có:
\(m_{CaSO3\left(1\right)}=\frac{6}{40+32+16.3}=0,05\left(mol\right)\)
\(n_{CaSO3\left(2\right)}=\frac{3}{40+32+16.3}=0,025\left(mol\right)\)
\(\Rightarrow n_{Ca\left(HSO3\right)2}=\frac{1}{2}n_{CaSO3\left(2\right)}=0,0125\left(mol\right)\Rightarrow n_{SO2}=n_{CaSO3\left(1\right)}+2n_{Ca\left(HSO3\right)2}=0,05+0,0125.2=0,075\left(mol\right)\)
\(\Rightarrow V=V_{SO2}=0,075.22,4=1,68\left(l\right)\)
Câu 2:
Gọi \(\left\{{}\begin{matrix}n_{BaSO3}:a\left(mol\right)\\n_{Ba\left(HCO3\right)2}:b\left(mol\right)\end{matrix}\right.\)
\(SO_2+Ba\left(OH\right)_2\rightarrow BaSO_3+H_2O\)
a______a ___________a___________
\(2SO_2+Ba\left(OH\right)_2\rightarrow Ba\left(HSO_3\right)_2\)
2b_______b _____________b
\(\Rightarrow\left\{{}\begin{matrix}a+2b=0,3\\217+299b=51,6\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow CM_{Ba\left(OH\right)2}=\frac{0,1+0,1}{0,2}=1M\)

Gọi T = \(\dfrac{n_{OH^-}}{n_{CO2}}=\dfrac{0,5+0,5\times0,02\times2}{0,5}=\dfrac{0,52}{0,5}=1,04\)
Có 1<T<2 => Tạo 2 muối
CO2 + 2OH\(^-\) -------> \(CO^{2-}_3\) + H2O
CO2 + OH\(^-\) --------> HC\(O_3^-\)
Lập hệ phương trình: => n\(_{CO3^{2-}}\) = n\(CO2_{\left(1\right)}\) = 0,02 (mol)
n\(_{Ba^{2+}}\) = 0,01 ( mol) => m\(_{BaCO_3}\) = 0,01\(\times\) 197 = 1,97 (g)

nCu= x mol; nAg= y mol
Cu + 2H2SO4→ CuSO4 + SO2↑ + H2O (1)
2Ag + 2H2SO4→ Ag2SO4 + SO2↑ + 2H2O (2)
SO2(k) + Br2 + 2H2O → H2SO4 + 2HBr (3)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl (4)
Theo PTPU (4), ta có: n↓= nBaSO4= nH2SO4 (4)= 0,08 mol
Theo PTPU (3), ta có: nSO2= nH2SO4 (4)= 0,08 mol
Theo PTPU (1) và (2), ta có: nSO2= nCu + 2nAg = x + 0,5y = 0,08 mol (5)
Tổng khối lượng hỗn hợp ban đầu: mhỗn hợp= mCu + mAg = 64x + 108y = 11,2 (6)
Giải hệ hai phương trình (5) và (6) ta được: x= 0,04 ; y= 0,08
→mCu= 0,04x64= 2,56 (g) →%mCu=2,56/11,2x100% = 22,86%
→%mAg= 100% - %mCu= 77,14%