Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nhiệt tạo thành chuẩn của khí methane là x
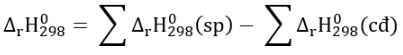
\(\rightarrow\) -890,3 = 2.(-285,8) -393,5 - x - 2.0
\(\rightarrow\) x = – 74,8 kJ/mol

Gợi Ý nhé:
Đối với loại toán này ta nên tìm cách tổ hợp từ các quá trình đã cho để loại đi các chất trung gian và được phương trình cần tính nhiệt phản ứng.
Từ các dữ kiện của bài toán ta có:
CO(NH2)2 (r) + 2HCl (k) \(\rightarrow\) COCl2 (k) + 2NH3 (k) - \(\Delta\)H3 = + 201,0 kJ
COCl2 (k) \(\rightarrow\) CO (k) + Cl2 (k) - \(\Delta\)H2 = + 112,5 kJ
CO (k) + H2O(h) \(\rightarrow\) CO2 (k) + H2 (k) \(\Delta\)H1 = - 41,3 kJ
H2O (l) \(\rightarrow\) H2O (h) \(\Delta\)H5 = 44,01 kJ
H2 (k) + Cl2 (k) \(\rightarrow\) 2HCl (k) 2. \(\Delta\)H4 = 2.(- 92,3) = - 184,6 kJ
Cộng theo từng vế các quá trình trên và loại đi các chất trung gian, ta thu được phương trình: CO(NH2)2 (r) + H2O (l) \(\rightarrow\) CO2 (k) + 2NH3 (k) có nhiệt của phản ứng là DH = (- \(\Delta\)3) + (- \(\Delta\)H2) + \(\Delta\)H1 + \(\Delta\)H5 + 2. \(\Delta\)H4. Thay số có \(\Delta\)H = 131,61 kJ.

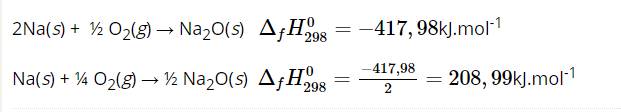
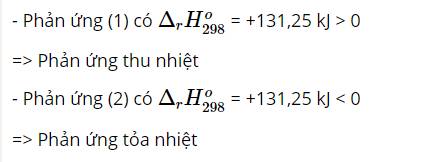



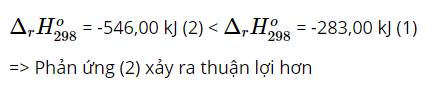

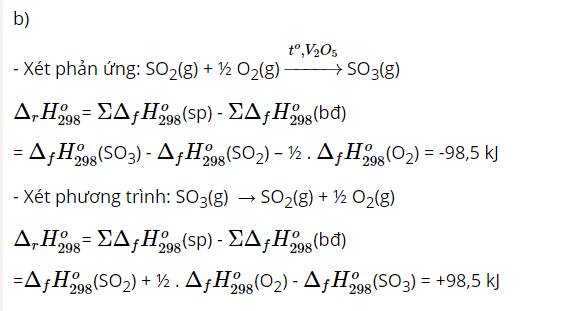

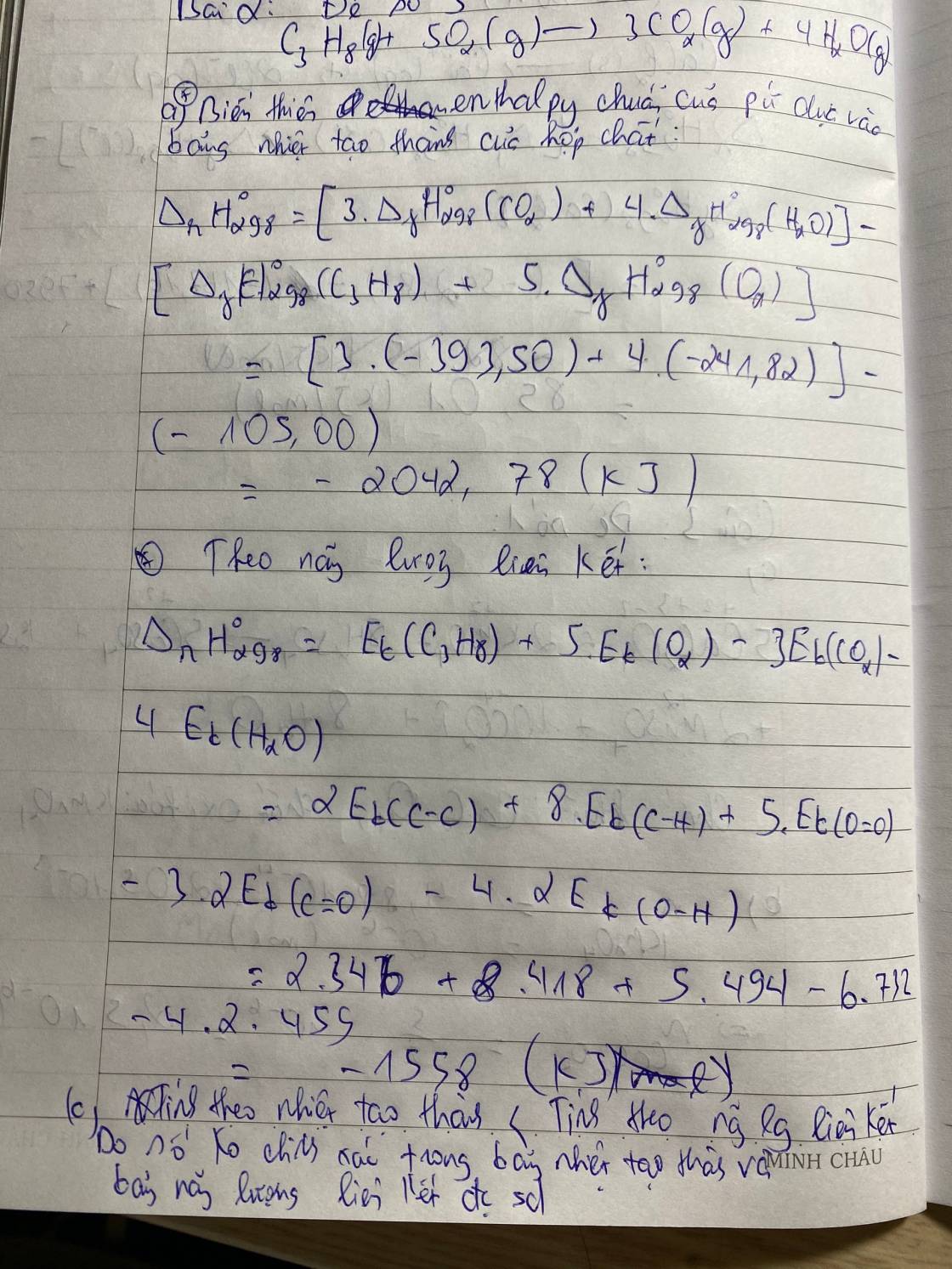
Chọn D vì:
Phương trình phản ứng: H2(g) + 0,5O2(g)-> H2O(l)
Vì khí O2 ở điều kiện chuẩn => nO2 = \(\dfrac{V}{24,79}\) = \(\dfrac{9,916}{24,79}\) = 0,4 (mol)
Có 0,5 mol O2 thì \(\Delta\)rHo298K = - 285,84 kJ
=> 0,4 mol O2 thì \(\Delta\)rHo298K = - \(\dfrac{285,84.0,4}{0,5}\) = - 228,672 kJ
Đáp án:
D
Giải thích các bước giải:
Phản ứng xảy ra:
$\rm H_2+\dfrac{1}{2}O_2\xrightarrow{t^°}H_2O$
$\rm n_{O_2}=\dfrac{9,916}{24,79}=0,4\ (mol)$
Quy tắc tam xuất:
$\rm\Delta_rH^°_{298}=\dfrac{0,4×(-285,84)}{0,5}=-228,672\ (kJ)$
Vì $\rm\Delta_rH^°_{298}<0$ nên đây là phản ứng toả nhiệt.