

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án B
Cho từ từ 0,1 mol HCl vào dung dịch X thì bắt đầu xuất hiện kết tủa, chứng tỏ trong X có 0,1 mol OH - , các ion còn lại là Na+, Al OH 4 - .
Cho từ từ 0,3 mol HCl vào X (TN1) hoặc cho 0,7 mol HCl vào X (TN2), thu được lượng kết tủa như nhau. Ở TN1, 0,1 mol H+ để trung hòa OH - , còn 0,2 mol H+ phản ứng với Al OH 4 - tạo ra 0,2 mol Al(OH)3. Suy ra ở cả hai thí nghiệm
![]()
ở TN1 chưa có hiện tượng hòa tan kết tủa, ở TN2 đã có hiện tượng hòa tan kết tủa.
Sơ đồ phản ứng :
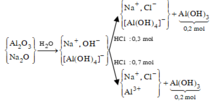
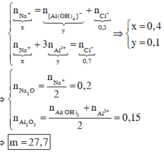
Áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng ở TN1, TN2, ta có :

200 ml dung dịch C chứa 0 , 2 mol CO 3 2 - 0 , 2 mol HCO 3 -
100 dung dịch D chứa 0 , 1 mol SO 4 2 - 0 , 3 mol H +
H+ + CO32- → HCO3-
0,2 ← 0,2 → 0,2
H+ + HCO3- → CO2 + H2O
0,1 → 0,1 → 0,1
⇒ V = 2,24 lít
Vậy dung dịch E còn (0,2 + 0,2 – 0,1) = 0,3 mol HCO3- và 0,1 mol SO42-
⇒ m = mBaCO3 + mBaSO4 = 0,3.197 + 0,1.233 = 82,4 ⇒ Chọn C.

Đáp án D
n H 2 = 0 , 13 m o l → n O H - = 0 , 26 m o l = 2 n B a + n N a
Đồng thời ta cũng giải được số mol Ba, Na lần lượt là 0,1 và 0,06 mol.
Ta có: m k e t t u a = 0 , 72 + 15 , 08 - 0 , 13 . 2 = 15 , 54 g a m
Trong X chứa 0,3a mol Al(NO3)3 và 0,2a mol Al2(SO4)3.
Giả sử số mol SO42- lớn hơn số mol Ba2+
suy ra ![]()
vậy kết tủa chứa BaSO4 0,1 mol.
→ m A l ( O H ) 3 < 0 vô lý
Vậy số mol SO42- nhỏ hơn số mol Ba2+ vậy kết tủa chứa 0,6a mol BaSO4
Số mol Al(OH)3 tối đa có thể tạo ra là 0,7a mol
→ n O H - k t m a x = 2 , 1 a < 0 , 2333
do vậy kết tủa có bị hòa tan một phần
→ n A l ( O H ) 3 = 4 n A l 3 + - n O H - = 2 , 8 a - 0 , 26
→ a = 1

Đáp án A
Tại catot có thể lần lượt xảy ra các quá trình:
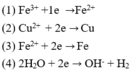
Tại anot có thể lần lượt xảy ra các quá trình:
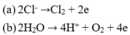
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi thu được hỗn hợp 2 oxit. Trong A có 2 loại ion kim loại
Mặt khác, khi điện phân dung dịch A cho đến khi hết ion Cl - thì catot tăng 6,4 gam
⇒ Quá trình (2) đã xảy ra một phần, Cu 2 + vẫn còn trong dung dịch sau điện phân.
Gọi số mol Fe 3 + , Cu 2 + , Cl - , SO 4 2 - trong 100ml dung dịch A lần lượt là a,b,c,d.
Khi điện phân hết 
Theo bảo toàn e: số e do Fe3+ và Cu2+ nhận bằng số mol Cl- nhường. a + 0,1.2 = c (1)
Khối lượng dung dịch giảm gồm Cu2+ và Cl- đã phản ứng và bị tách ra khỏi dung dịch
6,4 + 35,5c = 17,05 (2)
Sau khi điện phân A, cho dung dịch này phản ứng với NaOH thu được kết tủa B, nung B đến khối lượng không đổi được 16 gam 2 oxit
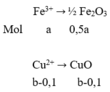
Suy ra: 160,0,5a + 80(b – 0,1) = 16 (3)
Theo định luật bảo toàn điện tích, đối với dung dịch A ta có:
3a + 2b = c + 2d (4)
Giải hệ phương trình ta được:
a = 0,1; b = 0,2; c= 0,3; d = 0,2
Khối lượng muối trong 100ml dung dịch A là 48,25 gam

Đáp án A
Từ giả thiết suy ra : Ở TN2 đã có hiện tượng hòa tan kết tủa. Còn ở TN1 thì có thể có hiện tượng hòa tan kết tủa hoặc chưa. Ta đặt :
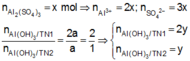
● Nếu cả TN1 và TN2 đều có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
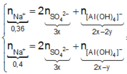
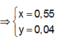
![]() thỏa mãn
thỏa mãn
Suy ra : ![]()
● Nếu TN1 chưa có hiện tượng hòa tan kết tủa, áp dụng bảo toàn điện tích cho các dung dịch sau phản ứng, ta có :
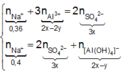
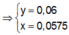
![]() (loại)
(loại)

Đáp án C
Ta có:
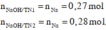
Theo giả thiết, suy ra : Ở TN2 kết tủa đã bị hòa tan một phần; ở TN1 kết tủa có thể đã bị hòa tan hoặc chưa.
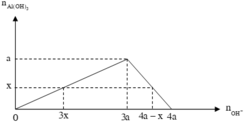
● Nếu ở TN1 kết tủa chưa bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:
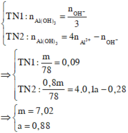
Suy ra : TN 1 : n Al ( OH ) 3 = 0 , 088 < n OH - 3 = 0 , 09 ( loại ) Vì như thế có nghĩa là đã có hiện tượng hòa tan kết tủa.
● Nếu ở TN1 kết tủa đã bị hòa tan thì căn cứ vào dạng hình học của đồ thị, ta có:
