Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(19,1gam\) \(:\left\{{}\begin{matrix}Al\\Mg\\Zn\end{matrix}\right.\)\(\underrightarrow{+O_2}\)\(Y:25,5gam\)\(\underrightarrow{+HCl}\left\{{}\begin{matrix}AgCl_3\\MgCl_2\\ZnCl_2\end{matrix}\right.\) + H2 : 0,3 mol
H2O
Áp dụng định luật bảo toàn khối lượng:
\(mO_2=25,5-19,1=6,4gam\) \(\Rightarrow nO_2=0,2\left(mol\right)\)
BTNT O : nH2O = 0,4mol
\(\rightarrow nHCl^-\left(tdOxi\right)=0,8\left(mol\right)\)
\(nH_2=0,3\left(mol\right)\rightarrow nCl^-\left(tdKl\right)=0,6\left(mol\right)\)
\(m_{muối}=19,1+\left(0,8+0,6\right).35,5=68,8\left(g\right)\)

\(m_O=\dfrac{15.12,8}{100}=1,92\left(g\right)\)
=> \(n_O=\dfrac{1,92}{16}=0,12\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Bảo toàn H: nHCl = 0,12.2 + 0,15.2 = 0,54 (mol)
=> nCl = 0,54 (mol)
mmuối = mhh rắn - mO + mCl
= 15 - 1,92 + 0,54.35,5 = 32,25 (g)

Đáp án D
Xét trường hợp 20,4 gam A tác dụng với dung dịch HCl dư:
Gọi số mol các chất là Al: a mol; Zn: b mol; Fe: c mol
Ta có:

Các quá trình nhường, nhận electron:
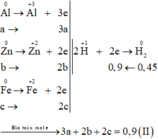
Xét trường hợp 0,2 mol A tác dụng với Cl2:
Gọi số mol các chất là Al: ka mol; Zn: kb mol; Fe: kc mol
Ta có:
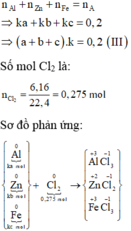
Các quá trình nhường, nhận electron:
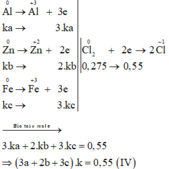
Lấy (IV) chia (III) vế với vế ta được:

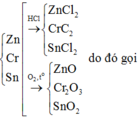
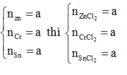




V2 - V1 = 2,016 lít nhé
TN1:
Al0 → Al+3 + 3e_____________2H+ + 2e → H2
Fe0 → Fe+2 + 2e
Zn0 → Zn+2 + 2e
BT electron\(\rightarrow\) 3nAl + 2nFe + 2nZn = 2nH2 (1)
TN2:
Al0 → Al+3 + 3e______________Cl2 + 2e → 2Cl-
Fe0 → Fe+3 + 3e
Zn0 → Zn+2 + 2e
BT electron\(\rightarrow\) 3nAl + 3nFe + 2nZn = 2nCl2 (2)
Lấy (2) - (1) được nFe = 2.(nCl2 - nH2) = 2.(2,016/22,4) = 0,18 mol
Mà theo đề bài các kim loại có số mol bằng nhau nên nAl = nFe = nZn = 0,18 mol
Vậy dung dịch Y chứa: AlCl3 (0,18 mol); FeCl2 (0,18 mol); ZnCl2 (0,18 mol)
→ m muối = 0,18.133,5 + 0,18.127 + 0,18.136 = 71,37 gam