Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

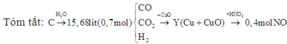
Quan sát – phân tích: Đề yêu cầu là tính phần trăm thể tích của CO. Vậy cái ta cần tìm chính là số mol của CO. Dựa vào sơ đồ ta nghĩ tới lập hệ phương trình 3 ẩn tương ứng với số mol của ba chất. Nhưng từ sơ đồ ta chỉ có thể lập được 2 hệ phương trình vậy thì không thể giải được bằng cách này. Vậy bài tập này sẽ có gì đó đặc biệt hoặc là phải biện luận. Khi viết phương trình phản ứng ra ta thấy:
Cả hai phương trình này đều tạo ra H2. Vậy chúng ta chỉ cần gọi 2 ẩn là có thể biểu diễn được số mol của H2 theo hai ẩn đó.
Kết hợp với dữ liệu còn lại ta tìm ngay được đáp án.
Gọi a và b lần lượt là số mol của CO và CO2 ⇒ Số mol của H2 là: n H 2 = a + 2 b
Theo giả thiết ta có: a + b +a + 2b = 0,7 ⇔ 2a + 3b = 0,7 (1)
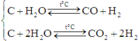
Ta có: C u + 2 → C u 0 → C u + 2
Vậy ta sẽ bỏ qua bước trung gian là Cu và coi rằng (CO và H2) phản ứng với HNO3 tạo ra sản phẩm khử NO.
Áp dụng định luật bảo toàn electron ta có:

Đáp án C.

nNO = 0,4 mol; nX = 0,7 mol
Xét toàn bộ quá trình ta có chỉ có 2 quá trình thay đổi số oxi hóa:
C0 → C+4 + 4e
N+5 + 3e → N+2
Bảo toàn e cho cả quá trình ta có: 4nC = 3nNO
⇒ nC = 0,3 mol
Bảo toàn C ta có: n CO + n CO2 = n C = 0,3 mol (1)
⇒ nH2 = 0,4 mol ⇒ n H2O = n H2 = 0,4 mol
Ta có: C + O(H2O) → CO, CO2
Bảo toàn nguyên tố oxi ta có: n CO + 2nCO2 = n H2O = 0,4 mol (2)
Từ (1)(2) ⇒ n CO = 0,2 mol; n CO2 = 0,1 mol
%VCO = (0,2 : 0,7) .100% = 28,57%
Đáp án C.

Chọn đáp án C
Y : C u C u O + → + H N O 3 0,4 mol NO
n C u = 3 2 . n N O = 0,6 mol
C O H 2 + O C u O → C u
n C O + n H 2 = n [ O ] C u O = n C u = 0,6 mol. Gọi n C O = x mol; n H 2 = y mol
x + y = 0,6 (1) => n C O 2 = 0,7 – 0,6 = 0,1 mol
Bảo toàn C và H ta có: n H 2 = n H 2 O = n [ O ] H 2 O = 2 n C O 2 + nCO
y = 2.0,1 + x => y – x = 0,2 mol (2)
Từ (1)(2) => x = 0,2; y = 0,4
% V C O = 0 , 2 0 , 7 .100% = 28,57%

Đáp án A
nCu = 1,5nNO = 0,6 => nCO + nH2 = nCu = 0,6
Theo định luật bảo toàn mol electron có
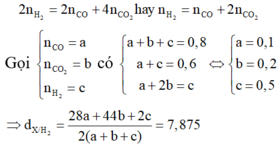

Quy đổi hỗn hợp 19.20g gồm Fe, FeO, Fe3O4 vào Fe2O3 dư.thành Fe và O bạn lập hệ giữa khối lượng và bảo toàn e với No2 tính đc nFe , vì Hỗn hợp A gồm Fe2O3,Fe3O4, FeO với số mol như nhau nên bạn gọi a là mol mỗi oxit và bảo toàn nguyên tố với nFe mk vừa tính đc xong tính đc x bảo toàn khối lượng --> y . nCo=nCo2=y/197
Chúc bạn học tốt!
Đáp án B
Đặt n C O P T 1 = x m o l ; n C O 2 P T 2 = y m o l
C + H 2 O → t 0 C O + H 2 ( 1 ) x x m o l C + 2 H 2 O → t 0 C O 2 + 2 H 2 ( 2 ) y 2 y m o l C O + C u O → t 0 C u + C O 2 ( 3 ) x x m o l H 2 + C u O → t 0 C u + H 2 O ( 4 ) ( x + 2 y ) ( x + 2 y ) m o l
Hỗn hợp khí X có x mol CO, y mol CO2; (x+2y) mol H2
→ x + y + x+ 2y= 15,68/22,4= 0,7 mol hay 2x +3y= 0,7 mol (I)
Tổng số mol Cu là x+x+2y= 2x+ 2y mol
3Cu + 8HNO3 → 3Cu(NO3)2+ 2NO+ 4H2O (1)
Theo PT (1): nNO= 2/3. nCu= 2/3 (2x+2y)= 0,4 (II)
Giải hệ (I, II) ta có: x= 0,2; y= 0,1
% V C O = % n C O = 0 , 2 0 , 7 . 100 % = 28 , 57 %