Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
MxOy + yCO ——> xM + yCO2
![]()
=> Tổng số mol khí trước và sau phản ứng là không đổi.
Hỗn hợp khí sau phản ứng là CO2 và CO dư
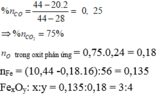

1)2 Al +6HCl--->2AlCl3 +3H2
Fe +2 HCl --->FeCl2 +H2
2) đặt nAl=x,nFe=y =>từ phương trình ở ý 1) và theo bài ra ta có;3/2.x+y=4.48/22.4 và 27x+56y=5.5.giải hệ hai phương trình=>x=0.1 và y=0.05=>mAl=27.0.1=2.7(gam)=>% về khối lượng của Al trong hỗn hợp=(2.7/5.5).100%=49.1%=>%về khối lượng của Fe trong hỗn hợp=100%-49.1%=50.9%.
3) pt : CuO + H2----> Cu +H2O.ta có nH2=0.2(mol),nCuO=0.1(mol)=>CuO pư hết và H2 dư=> nCu=nCuO=>mCuO=0.1 nhân 64=6.4 (gam).

Chọn C
Quá trình CO phản ứng với oxit chỉ là CO lấy đi O tạo CO2 nên số mol O bị lấy cũng chính bằng số mol CO2. Vì Ca(OH)2 dư ⟹ nCO2 = 34,8/100 = 0,348 = nO bị lấy
⟹ nFe trong oxit = (18,56 – 0,348×16)/56=0,232
⟹ n F e n O = 0 , 232 0 , 348 = 2 3 ⟹ Fe2O3
yCO+FexOy--t°--> yCO2+xFe
CO2+Ca(OH)2--->CaCO3+H2O nCaCO3=34,8/100=0,348(mol
Theopt2: nCO2=nCaCO3=0,348(mol)
Theo pt1:
nFexOy=1/y.nCO2=0,348/y (mol)
MFexOy=18,56/0,348/y=160y/3(g/mol)
=>56x+16y=160y/3
168x+48y=160y
168x=112y
=>x/y=112/168=2/3
Vậy công thức hoá học của Oxt sắt là Fe2O3



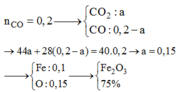

a/ Số mol của sắt oxit là: nFe2O3 = 1,6 : (56*2 +16*3) = 0,01 mol
PTHH : 3CO + Fe2O3 ____> 2Fe + 3CO2
3 1 2 3
0,03mol <__ 0,01 mol __> 0,02 mol ----> 0,03 mol
Khối lượng sắt thu được là: mFe = 0,02 * 56 = 1,12 (g)
b/ Thể tích cacbonic là: 0,03 * 22,4 = 0,672 (l)
ĐS:...