Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1:
A + Cl2 → ACl2 (1)
Fe + ACl2 → FeCl2 + A (2)
x x x (mol)
gọi số mol của Fe phản ứng với một số mol của ACl2 là x
khối lương thanh sắt sau phản ứng là:11,2 - 56x + xMA = 12
=> x =
Ta có:
= 0,25.0,4 = 0,1 (mol)
=> MA = 64 g/mol; Vậy kim loại A là Cu
= nCu =
= 0,2 (mol) =>
= 0,5M
bài 2:
(C17H35COO)3C3H5 + 3NaOH -> 3 C17H35COONa + C3H5(OH)3
890 kg 918 kg
x kg 720 kg
=> x = 698,04 kg.

HCHO có cấu tạo theo kiểu H-CO-H, cậu nhận thấy nó có 2 LK C-H; nên khi pư với Br2, nó điền thêm [O] vào các LK C-H đó; vấn đề là nó có thể điền vào 1 nhánh C-H hoặc cả hai nhánh
- Nếu chỉ điền vào một nhánh: tức pư với một phân tử Br2 ==> sp tạo thành là acid focmic:
H-COOH
- Nếu nó điền vào hai lần: tức pư với hai phân tử Br2 ==> sp tạo thành là:
HO-CO-OH = H2CO3 = H2O + CO2

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

nOH- = 0,04 mol
Vì nAlO2- = 0,02 mol mà chỉ thu được 0,01 mol kết tủa nên nHCl = 4n kết tủa + nAlO2- dư = 0,05 mol
=> tổng nH+ = 0,09 mol => V = 45ml
Vậy : B đúng
H+ + OH- => H2O 1
0,02......0,02
H+ + AlO2 - + H2O => Al(OH)3 2
0,02.....0,02.........................0,02
3H+ + Al(OH)3 => Al3+ +3H2O 3
0,03.........0,01
do cần V lớn nhất nên xét TH tạo kết tủa xong hòa tan 1 phần kết tủa
n Al(OH)3 =0,01 => nAl(OH)3 ở 3 =0,01
=> nHCl= 0,03 +0,02 +0,02 =0,07 => V=0,035 => C

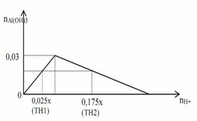
Al(x) Na(2x)
Na+H2O->NaOH + H2
2x -> 2x
Al + NaOH + H2O ->
x -> x
nNaOH dư x
NaOHdư + CuCl2 -> NaCl + Cu(OH)2
0,025 <- 0,025
NaOHdư + HCl -> ...
0,05 <- 0,05
----> nNaOH = (0,025.2 + 0,5).2 = 0,2
nAl = 0,1

Cho m gam hỗn hợp X gồm ( Fe , FeO , Fe2O3 ) có tỷ lệ khối lượng tương ứng là 7:18:40 .Hỗn hợp X tan vừa hết trong 500 ml H2SO4 loãng 0,68 M thu được dung dịch B và thoát ra V lít khí H2 ( đktc). Cho dung dịch B tác dụng NaOH dư lọc kết tủa nung khô trong không khí thu được 22,4 gam chất rắn. Giá trị của V là ?
A. 0,448
B. 0,896
C. 2,24
D. 1,12

Gọi công thức của Oxit Sắt là : \(Fe_xO_y\)
Các PTHH khi X vào HCl :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)(1)
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\frac{2y}{x}}+yH_2O\) (2)
nHCl ban đầu =\(\frac{200.14,6}{100.36,5}=0.8\left(mol\right)\)
\(n_{H_2}=\frac{2,24}{22,4}=0,1\left(mol\right)\Rightarrow m_{H_2}=0,1.2=0,2\left(g\right)\)
Từ (1) \(n_{Fe}=n_{H_2}=0,1\left(mol\right)\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right)\)
\(\Rightarrow m_{Fe_xO_y}=17,2-5,6=11,6\left(g\right)\Rightarrow n_{Fe_xO_y}=\frac{11,6}{56x+16y}\left(mol\right)\left(3\right)\) Từ (1) \(n_{HCl}=2n_{H_2}=2.0,1=0,2\left(mol\right)\)
\(m_{ddA}=200+17,2-0,2=217\left(g\right)\)
\(m_{ddB}=217+33=250\left(g\right)\)
\(n_{HCldu}=\frac{250.2,92}{100.36,5}=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=0,8-0,2-0,2=0,4\left(mol\right)\)
\(n_{Fe_xO_y}=\frac{1}{2y}n_{HCl}=\frac{1}{2y}.0,4=\frac{0,2}{y}\left(mol\right)\)(4)
Từ (3) và (4) ta có pt :\(\frac{11,6}{56x+16y}=\frac{0,2}{y}\Rightarrow\frac{x}{y}=\frac{3}{4}\)
Vậy CT Oxit cần tìm là :Fe3O4
 với các chất sau:
với các chất sau:
Đáp án cần chọn là: B